
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 可逆反应只是代表少数反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
分析 A.化学变化是旧键断裂新键形成的过程,断键成键都有能量变化;
B.温度、浓度、压强能够影响化学反应速率和平衡移动;
C.很多化学反应属于可逆反应;
D.达到化学平衡状态时正逆反应速率一定相等.
解答 解:A.化学变化是旧键断裂新键形成的过程,断键成键都有能量变化,所以物质发生化学反应都伴随着能量变化,故A正确;
B.外界条件能够影响化学反应速率和平衡移动,则化学反应的速率和限度均可通过改变化学反应条件而改变,故B正确;
C.可逆反应为一大类反应,不是少数的,大部分化学反应存在可逆现象,故C错误;
D.可逆反应达到平衡状态时,正逆反应速率一定相等,故D正确;
故选C.
点评 本题考查了化学平衡状态特征、影响化学反应速率、化学平衡的因素等知识,题目难度不大,明确外界条件对化学反应速率、化学平衡的影响为解答关键,C为易错点,注意可逆反应为一类反应,不是少数反应.


科目:高中化学 来源: 题型:推断题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,180g淀粉水解得到葡萄糖的分子数为NA | |
| B. | 1 mol C10H22分子中共价键总数为31 NA | |
| C. | 室温下,4.4 g乙醛和乙酸乙酯的混合物含有的碳原子数为0.2 NA | |
| D. | 88.0g干冰中含有的共用电子对对数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
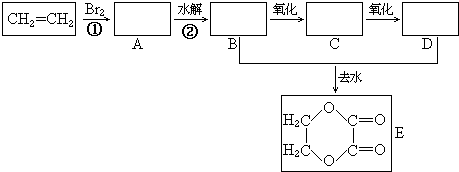
 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
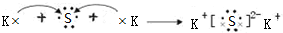 ,其化合物中化学键的类型是离子键.
,其化合物中化学键的类型是离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:D>M>N>A | B. | 反应②中H2是氧化产物 | ||
| C. | 金属性:A>N>D>M | D. | 氧化性:M2+>N2+>A2+>D2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SO2有漂白性,所以它能使品红溶液、溴水褪色 | |
| B. | SO2和Cl2都有漂白作用,将两种气体同时作用于湿润的有色布条,漂白效果更好 | |
| C. | 在有些反应中显示氧化性,在有些反应中显示还原性 | |
| D. | 将SO2气体通入装有FeCl3溶液的试管里,黄色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com