
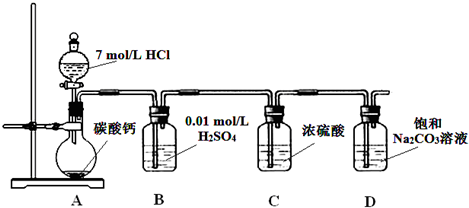
某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):

(1)D中产生NaHCO3的化学方程式是 。
(2)请结合化学平衡移动原理解释B中溶液的作用 。
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000 mL溶液作为样液,其余固体备用):
① 方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 。
② 方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是 。
该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?_____。
③ 方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400 mL,用pH计测溶液pH,再水浴加热蒸发至200 mL,接下来的操作是 ,结果表明白色固体中存在NaHCO3。为进一步证明白色固体是否为纯净的NaHCO3 ,结合甲同学实验,还应补充的实验是 。
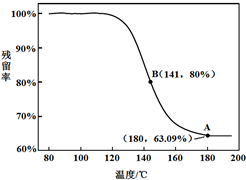
乙同学:利用仪器测定了固体残留率随温度变化的曲线,如下图所示。

a. 根据A点坐标得到的结论是 。
b. 根据B点坐标,计算残留固体中n(NaHCO3:n(Na2CO3))=
。
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3。
(1)Na2CO3+CO2+H2O = 2NaHCO3 (2分)
(2)CO2在水中存在平衡:CO2+H2O H2CO3
H2CO3 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)
(3)① Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3。(2分)
② 2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O(2分)
合理(1分)
③ 接下来的操作:冷却到室温,加水至溶液体积为400 mL,再次测定pH(2分)
补充实验:取相同质量的纯净的NaHCO3配成1000 mL溶液,取400 mL,重复甲的实验,进行对照。(2分)
a.白色固体为NaHCO3 (2分)
b.71:42(或1.69)(1分)
【解析】
试题分析: A装置中反应制备CO2,其中有杂质HCl、H2O(g),B装置既减少CO2的溶解,又能吸收HCl,C装置干燥CO2,D装置制备碳酸氢钠。(3)Na2CO3和NaHCO3都能和Ca(OH)2反应生成白色沉淀,方案1不合理,方案2 Na2CO3和BaCl2反应有白色沉淀,NaHCO3和BaCl2反应有白色沉淀和气体,因此可以确定NaHCO3存在,但不能确定Na2CO3的存在。方案3 Na2CO3和NaHCO3溶液都显碱性,但水解程度不同,可通过比较PH值前后大小进行区别。乙同学在温度为180时,残留率正好符合NaHCO3完全分解的计算,B点根据差量法进行计算,设原来有100克NaHCO3,反应后剩余80克,减少20克是CO2和H2O的质量,列方程组计算。
考点:考查化合物的制备、基本实验原理、实验设计、方程式的书写、物质的量的计算


科目:高中化学 来源: 题型:阅读理解
| 剩余固体的质量 | 原始固体的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3. | 在白色浑浊物中加入过量盐酸,变澄清 在白色浑浊物中加入过量盐酸,变澄清 . |
| 假设2 | 白色浑浊物是BaSO4,造成原因是 BaCl2溶液中溶解的氧气把亚硫酸氧化成硫酸 BaCl2溶液中溶解的氧气把亚硫酸氧化成硫酸 . |
把BaCl2溶液煮沸,冷却后滴加苯液封,再通入SO2.出现轻微浑浊. |
| 假设3 | 白色浑浊物是BaSO4,造成原因是 SO2中混有空气,把亚硫酸氧化成硫酸 SO2中混有空气,把亚硫酸氧化成硫酸 . |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中.不出现浑浊. |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省潍坊高密市高三4月月考理综化学试卷(解析版) 题型:实验题
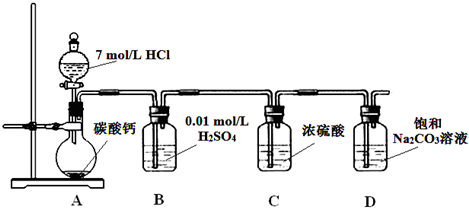
Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):

(1)请结合化学平衡移动原理解释B中溶液的作用?? ??????????????????????? ??? 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是?? ??????????????????????????????? ?? 。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器b中可选择的试剂为(任意填一种)???????????? 。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为?????????????? 。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积??????? (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据??????? (填序号)。
a.B装置实验前后质量差mg;???? b.F装置实验前后液面差VL
c.D装置实验前后质量差mg;???? d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是????????????????????????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随温度变化的曲线,如图所示.
随温度变化的曲线,如图所示.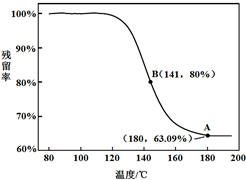
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com