
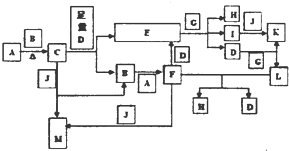
分析 G为黄绿色气体单质,则G为Cl2,I为“84”消毒液的有效成分,则I为NaClO,E和G反应生成H、I、D,D在通常情况下为无色无味的液体,则D为H2O,该反应应为氢氧化钠与氯气的反应,所以可以推断得,E为NaOH,H为NaCl,A为活泼金属单质,B为无色、无味气体,根据A、B反应生成C,C与过量的水反应生成氢氧化钠和B,则B为O2,A为Na,C为Na2O2,J为无色、无味气体,能与过氧化钠反应,所以J为CO2,M为Na2CO3,氧气与钠反应生成F为Na2O,D与G反应生成K和L,且I和J反应生成K,所以K为HClO,L为HCl,氧化钠与盐酸反应生成氯化钠和水,符合各物质的转化关系,据此答题.
解答 解:G为黄绿色气体单质,则G为Cl2,I为“84”消毒液的有效成分,则I为NaClO,E和G反应生成H、I、D,D在通常情况下为无色无味的液体,则D为H2O,该反应应为氢氧化钠与氯气的反应,所以可以推断得,E为NaOH,H为NaCl,A为活泼金属单质,B为无色、无味气体,根据A、B反应生成C,C与过量的水反应生成氢氧化钠和B,则B为O2,A为Na,C为Na2O2,J为无色、无味气体,能与过氧化钠反应,所以J为CO2,M为Na2CO3,氧气与钠反应生成F为Na2O,D与G反应生成K和L,且I和J反应生成K,所以K为HClO,L为HCl,氧化钠与盐酸反应生成氯化钠和水,符合各物质的转化关系,
(1)根据上面的分析可知,F为Na2O,J为CO2,K为HClO,
故答案为:Na2O;CO2;HClO;
(2)①A+B为钠与氧气反应生成过氧化钠,反应的方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,
②C+J为过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,
③E+G为氢氧化钠与氯气反应生成次氯酸钠和氯化钠,反应的离子方程式为2OH-+Cl2=H2O+Cl-+ClO-,
④M+L (过量)为碳酸钠与过量的盐酸反应生成氯化钠、二氧化碳和水,反应的离子方程式为CO32-+2H+=H2O+CO2↑,
故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;2Na2O2+2CO2=2Na2CO3+O2;2OH-+Cl2=H2O+Cl-+ClO-;CO32-+2H+=H2O+CO2↑.
点评 本题综合考查无机框图物质的推断,侧重考查Na、Cl2及化合物知识,注意根据物质的颜色、性质进行推断,解题的关键是根据各物质的转化关系进行推断,需要学生熟练掌握元素化合物知识,题目难度较大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO${\;}_{3}^{-}$+OH-+Ca2+═CaCO3↓+H2O | |
| C. | C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO${\;}_{3}^{2-}$ | |
| D. | 用惰性电极电解MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
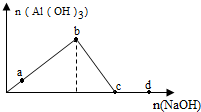
| A. | a点对应的溶液中:K+、NH4+、I-、CO32- | |
| B. | b点对应的溶液中:Na+、H+、S2-、Cl- | |
| C. | c点对应的溶液中:NH4+、H+、NO3-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
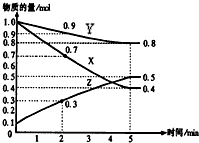 在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氯甲烷分子为正四面体结构 | |
| B. | 2-丁烯分子中4个碳原子不在同一平面内 | |
| C. | 甲苯分子中7个碳原子都在同一平面内 | |
| D. | 丙烷分子中的3个碳原子一定在同一条直线上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com