
 SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.| 催化剂 |
| △ |
| ①+② |
| 2 |
| 催化剂 |
| △ |
| ||
| 40s |
| c2(SO3) |
| c2(SO2)?c(O2) |
| (0.16)2 |
| (0.04)2×0.02 |
| ①+② |
| 2 |
| 4.48L |
| 22.4L/mol |


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
| A、BaCl2 和(NH4)2C03 |
| B、AgNO3 和 NH4Cl |
| C、FeCl3和 NaHCO3 |
| D、KCl 和 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知下列反应(反应所需的条件、反应物的浓度和方程式中各物质的化学计量数均已略去):
已知下列反应(反应所需的条件、反应物的浓度和方程式中各物质的化学计量数均已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
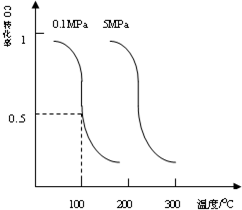 研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是
为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如图所示:实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50mL 5.0mol?L-1 NaOH溶液的烧杯中.试回答下列问题:
某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如图所示:实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50mL 5.0mol?L-1 NaOH溶液的烧杯中.试回答下列问题:| 实验操作过程 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 80.0 | |
| 烧杯+溶液+样品 | 0 | 87.8 |
| 1 | 87.5 | |
| 2 | 87.3 | |
| 3 | 87.2 | |
| 4 | 87.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(A) |
| c(B) |
| c(A) |
| c(B) |
| A、在该温度下,保持容积固定不变,向容器内补充了B气体,则a>b |
| B、保持温度、压强不变,充入惰性气体,则有a<b |
| C、若其他条件不变,升高温度,则有a<b |
| D、若a=b,容器中一定使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、AlO2-、Cl- |
| B、Na+、Cl-、SO42-、HCO3- |
| C、NH4+、Fe3+、NO3-、SO42- |
| D、Ba2+、Na+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com