
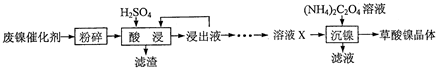
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
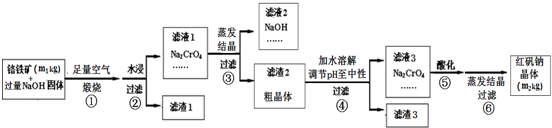
| 结晶温度/℃ | Na2CrO4粗晶中各物质含量/w% | |||
| Na2CrO4?4H2O | NaOH | Na[Al(OH)4] | Na2SiO3 | |
| 30 | 52.45 | 29.79 | 8.69 | 12.21 |
| 40 | 68.81 | 20.49 | 8.46 | 10.84 |
| 50 | 60.26 | 27.96 | 10.36 | 9.32 |
| 60 | 50.74 | 29.66 | 10.40 | 12.25 |
| 70 | 46.77 | 33.06 | 8.10 | 6.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制阿司匹林时用水洗涤产品,而在制摩尔盐时用酒精洗涤产品 |
| B、纸层析法通常把不与水混溶的有机溶剂作为固定相 |
| C、中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| D、减压过滤装置中,布氏漏斗的颈口斜面应与吸滤瓶的支管口相对,以便于吸滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.0O | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
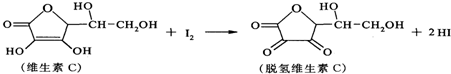
| A、上述反应为取代反应 |
| B、维生素C在酸性条件下水解只得到1种产物 |
| C、维生素C具有氧化性 |
| D、脱氢维生素C的分子式为C6H6O6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com