
| A. | 长度 | B. | 质量 | C. | 数量 | D. | 物质的量 |
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁、铝的熔点很高,可用于制耐火坩埚 | |
| B. | 小苏打受热分解生成气体,可用作发酵粉 | |
| C. | 铁的活泼性较强,铁粉可用作食品袋内的脱氧剂 | |
| D. | Na、Cu等金属化合物焰色反应呈现各种艳丽色彩,可制成节日烟花 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
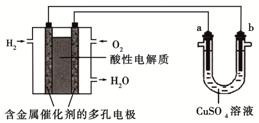
| A. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- | |
| B. | a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极均是石墨时,a极上产生的O2与电池中消耗的H2的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和Cl2恰好完全反应 | B. | 生成99gFeCl3 | ||
| C. | 会有9.33gFe过量 | D. | 会有17.75gCl2过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 方程式 | 结论 |
| A | 2AgI(s)+S2-(aq)?Ag2S(s)+2I-(aq) | 溶解度:Ag2S>AgI |
| B | C(s.石墨)═C(s.金刚石)△H>0 | 稳定性:金刚石>石墨 |
| C | 3Fe2++NO${\;}_{3}^{-}$+10H+═3Fe3++3H2O+NH${\;}_{4}^{+}$ | 还原性:Fe2+>NH${\;}_{4}^{+}$ |
| D | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+S$\frac{\underline{\;加热\;}}{\;}$FeS | 氧化性:Cl2>S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和氯化铁溶液反应:Fe3++Fe═2Fe2+ | |
| B. | 醋酸和氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| C. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+H2O | |
| D. | 氢氧化铁和盐酸反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com