
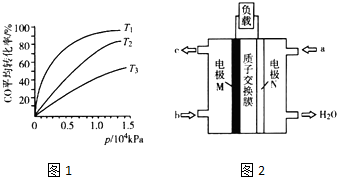
| 容器换号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH2(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
分析 (1)CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1①
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1②
将方程式 $\frac{①+②}{2}$得甲烷直接将NO2还原为N2的热化学方程式;
(2)依据亚硝酸根离子水解平衡常数表达式变式计算分析;
(3)正反应放热,则升高温度CO的转化率降低;
(4)对比I、Ⅱ可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动;
根据I中数据计算平衡常数,计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(5)原电池中阳离子移向正极,负极是甲醇失电子发生氧化反应,依据电池反应和酸性环境,2CH3OH+3O2=2CO2+4H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式;电池的正极反应式为:O2+4H++4e-=2H2O;
解答 解:(1)CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1①
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1②
将方程式$\frac{①+②}{2}$CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=$\frac{-574-1160}{2}$kJ/mol=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1;
(2)NO2-+H2O?HNO2+OH-,Kh=$\frac{c(HN{O}_{2})c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=$\frac{c(HN{O}_{2})c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$×$\frac{c({H}^{+})}{C({H}^{+})}$=$\frac{Kw}{Ka}$,则Kw=Kh×Ka=8.0×10-10mol•L-1×9.7×10-4mol•L-1=7.76×10-13,>常温下Kw=10-14,温度高于常温,>25°C,
故答案为:Ka×K;>;
(3)根据该反应为放热反应,温度越高CO的转化率越小,图中T1、T2、T3的高低顺序T1<T2<T3,
故答案为:T1<T2<T3,该反应为放热,温度越高,反应物的转化率越低;
(4)对比I、Ⅱ可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动,则正反应为放热反应,容器Ⅰ中平衡时c(CH3OCH3)=c(H2O)=$\frac{0.08mol}{1L}$=0.080mol/L,c(CH3OH)=$\frac{0.2mol-0.08mol×2}{1L}$=0.04mol/L,容器Ⅰ中化学平衡常数K1=$\frac{0.08×0.08}{0.0{4}^{2}}$=4,此时浓度商Qc=$\frac{0.15×0.1}{0.1{5}^{2}}$=0.67<K=4,反应向正反应进行,
故答案为:放热,正;
(5)图分析可知a端电极N为正极,质子穿过交换膜移向N电极,M电极为负极,负极是甲醇失电子发生氧化反应,依据电池反应和酸性环境,2CH3OH+3O2=2CO2+4H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,故答案为:N,CH3OH+H2O-6e-=CO2+6H+.
点评 本题目综合考查盖斯定律的应用、化学反应平衡常数的计算和应用、图象分析判断等方面的知识,侧重于影响平衡移动及平衡常数的因素的考查,注意知识的归纳和整理是关键,题目难度中等.注意料电池反应的特点.


科目:高中化学 来源: 题型:解答题
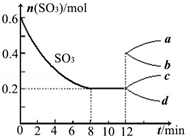 在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCI+NaOH═NaCl+H2O | |
| B. | Zn+2HCl═ZnCl2+H2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | MnO2+4HCI (浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3和 Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
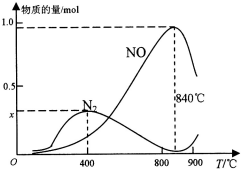 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为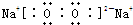 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 g甲基(-CH3)所含电子数目为NA | |
| B. | 0.1 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| C. | 由2H和18O所组成的水11 g,其中所含的中子数为5NA | |
| D. | 1 mol Fe溶于过量硝酸,电子转移数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com