
【题目】将SO2气体通入KIO3淀粉溶液,溶液先变蓝后褪色。此过程中SO2表现出
A.漂白性B.氧化性和漂白性
C.还原性D.还原性和漂白性
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
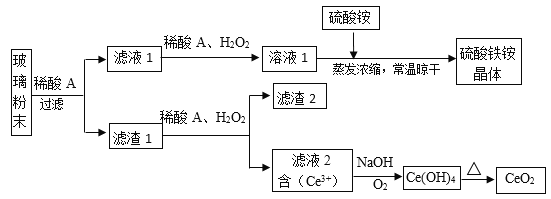
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式___________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:______________________________,相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A. 反应达平衡时,X的转化率为50%
B. 反应可表示为:X+3Y![]() 2Z,其平衡常数为1 600
2Z,其平衡常数为1 600
C. 改变压强可以改变此反应的平衡常数
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X( g)+Y( g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前4min的平均反应速率υ(Z)=0.0125molL-1min-1
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C. 其他条件不变,再向体系中冲入1L氦气,使体系压强增大,则υ(逆)与υ(正)同等程度增大
D. 该温度下此反应的平衡常数K=1.44
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,合成氨反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g);△H=﹣92.4kJ/mol,在该温度下,取1mol N2和3mol H2放在密闭容器内反应.下列说法正确的是( )
2NH3(g);△H=﹣92.4kJ/mol,在该温度下,取1mol N2和3mol H2放在密闭容器内反应.下列说法正确的是( )
A. 在有催化剂存在的条件下,反应放出的热量为92.4 kJ
B. 有无催化剂该反应放出的热量都为92.4 kJ
C. 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ
D. 反应放出的热量始终小于92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年以来我国北方的“雾霾”污染日益严重。中科院“大气灰霾追因与控制”项目针对北京强霾过程进行分析,强霾过程中,出现了大量有毒有害的含氮有机颗粒物。燃煤和机动年尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②OCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
③H2O(g)=H2O(1)△H=-44.0kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________________________。
(2)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程中NO的物质的量随时间变化如下图所示。

①写出该反应的化学方程式:________________________________。
②10min内该反应的速率v(N2)=___________;该反应达平衡时CO的转化率为___________;T℃时该化学反应的平衡常数K=___________。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是________。

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再改变
c.2v正(NO)=v逆(N2) d.气体的密度保持不变
(3)以燃料电池为代表的新能源的推广“使用能大大降低污染物的排放。如图是一种甲醚燃料电池结构,请写出该电池负极的电极反应式:________________________________________。
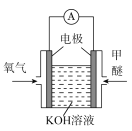
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:A(g)+ B(s) ![]() 2C(g)+ D(g) ΔH=a kJ·mol-1,其中a>0.现在T℃下,向容积为2L的恒温容器中充入2molA和2molB发生反应。其中A的含量变化如下表所示:
2C(g)+ D(g) ΔH=a kJ·mol-1,其中a>0.现在T℃下,向容积为2L的恒温容器中充入2molA和2molB发生反应。其中A的含量变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n (A)/mol | 2 | 1.5 | 1.2 | 1.1 | 1.05 | 1.0 | 1.0 |
(1)从反应开始进行到反应进入平衡状态,物质C的平均反应速率V(c)=________,物质A的转化率为_____________。
(2)下列选项中能够证明该反应已经达到平衡状态的有__________
A.容器内气体密度保持不变 B.容器内压强保持不变
C.物质A、C、D的物质的量之比n(A):n(C):n(D) = 1:2:1
D.物质B的浓度保持不变 E.物质B的质量保持不变
(3)反应达到平衡后,下列措施能使A的转化率增大且使反应速率加快的是____(填符号)。
A.保持容积不变,充入He气 B.缩小容器体积以增大压强 C.增加B物质的含量
D.将C(g)从体系中分离 E.升高反应温度 F.向体系中再加入2molA物质
(4)T℃下,该反应的平衡常数K值为__________。若升高体系温度,K将_______(填“增大”“减小”或“不变”),理由是________________________________________。
(5)同一温度下,再次进行上述反应。起始时向相同的容器中加入1molA和1molB,某一时刻测得体系压强变化为初始时刻压强的2倍,则此时物质D的浓度C(D)=________;此时该反应V正________V逆(填“大于”“小于”或“等于”),理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纠错题
(1)有机物命名要规范,熟悉系统命名法。请指出下列命名中的错误,并订正。
①(CH3)2CHC≡CH:3,甲基1,丁炔或2甲基3丁炔 订正________________________。
②CH2Cl—CH2Cl:二氯乙烷 订正________________________________。
(2)化学式、键线式、结构式、结构简式等不能混同。请订正下面的错误。
①乙醇的化学式为CH3CH2OH 订正________________________________。
②1,4二溴2丁烯的键线式:BrCH2CH===CHCH2Br 订正________________________。
(3)官能团、取代基及原子间的连接方式要正确,官能团写在左边时要特别注意。请订正下面的错误。
①对苯二酚![]() 订正_______________________________________。
订正_______________________________________。
②聚丙烯:![]() 订正________________________________________。
订正________________________________________。
(4)书写有机化学方程式时,有机物一般要写成结构简式或结构式,并注明反应条件,反应前后原子要守恒。请订正下面方程式的错误。
①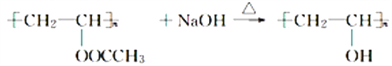 订正_________。
订正_________。
②![]()
![]() 订正___。
订正___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com