
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1molL-1的(NH4)2SO4溶液,用离子方程式表示该溶液显酸性的原因:___,在该溶液中各种离子浓度由大到小的顺序为___。
(2)B为0.1molL-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:__(用离子方程式和必要的文字说明)。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入__,目的是___;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
【答案】NH4++H2ONH3·H2O+H+ c(NH4+)>c(SO42-)>c(H+)>c(OH-) 在NaHCO3溶液中存在HCO3-的水解平衡为:HCO3-+H2OH2CO3+OH-,电离平衡为:HCO3-H++CO32-;而以水解为主,即HCO3-的水解程度大于电离程度溶液,溶液显碱性 盐酸 抑制Fe3+水解 Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
【解析】
(1)依据溶液中铵根离子水解,溶液呈酸性,水解程度微弱,分析比较;
(2)在NaHCO3溶液中存在碳酸氢根离子的水解平衡和电离平衡;水的电离平衡;溶液显碱性是因为溶液中碳酸氢根离子的水解程度大于电离程度;
(3)配制氯化铁溶液需要防止水解而变浑浊;NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体。
![]() 铵根离子水解,溶液呈酸性,用离子方程式表示为:
铵根离子水解,溶液呈酸性,用离子方程式表示为:![]() ;
;![]() 的
的![]() 溶液中,铵根离子水解微弱,所以得到溶液中的离子浓度大小为:
溶液中,铵根离子水解微弱,所以得到溶液中的离子浓度大小为:![]() ;
;
![]() 在
在![]() 溶液中存在
溶液中存在![]() 的水解平衡为:
的水解平衡为:![]() ,电离平衡为:
,电离平衡为:![]() ;而以水解为主,即
;而以水解为主,即![]() 的水解程度大于电离程度溶液,溶液显碱性;
的水解程度大于电离程度溶液,溶液显碱性;
![]() 实验室中配制
实验室中配制![]() 溶液时通常需要向其中加盐酸抑制
溶液时通常需要向其中加盐酸抑制![]() 水解,
水解,![]() 溶液和
溶液和![]() 溶液混合发生双水解生成氢氧化铁红褐色沉淀和二氧化碳气体;反应的离子方程式为:
溶液混合发生双水解生成氢氧化铁红褐色沉淀和二氧化碳气体;反应的离子方程式为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是K层电子数的3倍,Z的焰色反应显黄色。常温下,Z和W形成化合物的水溶液的pH=7。下列说法正确的是( )
A.Z和W形成化合物的水溶液与Y 单质反应,能置换出W
B.简单离子半径:X<Z
C.简单氢化物的沸点:Y>W>X
D.单质W的熔沸点高于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列5种有机物
①![]() ②
②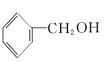 ③
③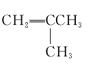 ④
④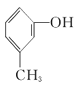 ⑤
⑤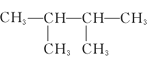
请回答下列问题:
(1)其中互为同系物的是____________和____________,互为同分异构体的是____________和____________(用序号回答)。
(2)用系统命名法给⑤命名,其名称为____________。
(3)有机物②核磁共振氢谱中有____________个峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应2SO2+O2![]() 2SO3是放热反应,下列说法正确的是( )
2SO3是放热反应,下列说法正确的是( )
A.2 molSO2与1molO2能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率
B.2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
C.2mol SO2与1 molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
D.2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.再加入10 mL pH=11的NaOH溶液,混合液的pH=7
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用单质A模拟工业上制备含氧酸D的过程如图所示,已知D为强酸,请回答下列问题。
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了____________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A的化学式是____________;C的化学式是____________。
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O![]() Fe2O3+ SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
Fe2O3+ SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
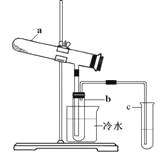
A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42—
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CaSO4代替O2与燃料CO反应是一种高效、清洁的新型燃烧技术,发生如下反应:
①![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g) ![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
下列说法错误的是 ( )
A. 反应①达到平衡时,增大压强平衡不移动
B. 反应②的平衡常数表达式为K=![]()
C. 反应①和②是主反应,反应③是副反应
D. 2CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com