
| A. | SrCO3的溶解度不变,KSP不变 | B. | SrCO3的溶解度不变,KSP增大 | ||
| C. | SrCO3的溶解度增大,KSP不变 | D. | SrCO3的溶解度减小,KSP增大 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向铁粉中加入一定量的稀硝酸 | |
| B. | 向MgSO4,H2SO4的混合液中滴入过量Ba(OH)2溶液 | |
| C. | 向NaOH溶液中通入一定量CO2气体 | |
| D. | 将物质的量浓度之比为2:7的AlCl3和NaOH溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
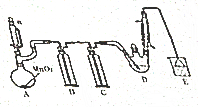 某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1 L 1 mol/L 的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| B. | 制成0.5 L 10 mol/L 的盐酸,需要氯化氢气体 112L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2 溶液中,Ba2+ 和Cl- 总数位3×6.02×1023 | |
| D. | 10 g 98% 硫酸 (密度为 1.84g/cm3)与10 mL 18.4 mol/L 硫酸的浓度是不同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
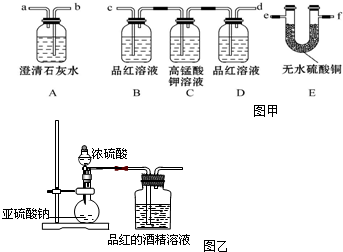
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com