
【题目】通常用来衡量一个国家石油化工发展水平标志的是( )
A.甲烷的产量
B.苯的产量
C.乙醇的产量
D.乙烯的产量
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加)。下列判断错误的是

A. 由图中信息可知,HA一定是强酸
B. 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol·L-1
C. N点对应的溶液中c(M+)=c(A-)
D. K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去). 
(1)【背景素材】
①2NO+Na2O2═2NaNO2;
②NO能被酸性KMnO4氧化成NO3﹣ , MnO4﹣被还原为Mn2+ .
③在酸性条件下NaNO2能把I﹣氧化为I2;S2O32﹣能把I2还原为I﹣ .
【制备NaNO2】
(i)装置A三颈烧瓶中发生反应的化学方程式为 .
(ii)B装置的目的是① , ② .
(iii)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是(填序号).
A.P2O5 B.碱石灰 C.无水CaCl2 D.生石灰
(iv)E装置的作用是 .
(2)【测定NaNO2纯度】
可供选择的试剂有:
A.稀硫酸 B.c1 molL﹣1 KI溶液 C.淀粉溶液 D.c2 molL﹣1 Na2S2O3溶液
E.c3 molL﹣1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是(填序号).
②利用NaNO2的氧化(请补充完整实验步骤).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )
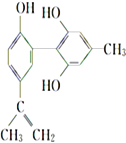
A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 该分子中的所有碳原子一定共平面
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol
D. 滴入KMnO4酸性溶液,观察到紫色褪去,能证明结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或离子方程式正确的是
A. 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH![]() CH3CH=CH2↑+NaCl+H2O
CH3CH=CH2↑+NaCl+H2O
B. 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
C. 乙醛溶液中加入新制碱性Cu(OH)2悬浊液并加热CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
D. 向小苏打溶液中加入醋酸:CO32-+2CH3COOH===CO2↑+H2O+2CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关“油”的说法正确的是( )
A.油脂包括矿物油、植物油与动物油
B.油脂的氢化与油脂的皂化都属于加成反应
C.植物油能使碘酒褪色
D.油脂属于高分子化合物,可以发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 常温下,pH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同
B. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
C. 向浓度均为0.1 molL-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D. 向盛有KI3溶液(I3-![]() I2+I-)的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-)的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3、MaHCO3及xNa2CO3·yH2O(过碳酸的)在工农业生产上用途非常广泛。
(1)0.1mol/LNa2CO3溶液加水稀释时,溶液的pH____ (填“增大”、“减小”或“不变”)。
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O![]() H2CO3+OH-的平衡常数为K= ________ 。(填数值)
H2CO3+OH-的平衡常数为K= ________ 。(填数值)
②反应HCO3-+NH3·H2O![]() CO32-+NH4++H2O的平衡常数为K=_________。 (填数值)
CO32-+NH4++H2O的平衡常数为K=_________。 (填数值)
(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:

①滴定CO32-时,终点溶液颜色变化是______。
②滴定H2O2时,MnO4-被还原为Mn2+,反应的离子方程式为_______。
③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。y/x的值(列出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烷烃A的碳原子数是5,则符合A的结构有____________ 种,其中含有四个甲基的系统命名为________________________________ ;
(2)烷烃B在同温同压下蒸气的密度是H2的43倍,则B的分子式为____________,其中含有3个-CH3的同分异构体的结构简式为___________________________、________________________________;
(3)某气态烃在标准状况下的密度为2.59g/L,该烃的含碳量为82.8%,则分子中碳、氢原子的个数比是______________,分子式是_________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com