
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
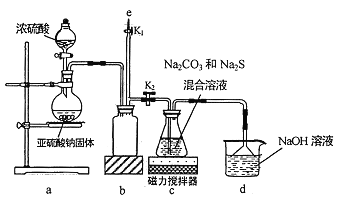
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
【答案】控制反应温度或调节酸的滴加速度安全瓶,防止倒吸SNaOH溶液打开K1关闭K2酸式滴定管滴入最后一滴硝酸银溶液,出现黄色沉淀,且半分钟内沉淀不消失否
【解析】
【实验一】a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气。
(1)实验中要控制SO2生成速率,可采取的措施有:控制反应温度、调节酸的滴加速度或调节酸的浓度等,故答案为:控制反应温度、调节酸的滴加速度或调节酸的浓度;
(2)由仪器结构特征,可知b装置为安全瓶,防止倒吸,故答案为:安全瓶,防止倒吸;
(3)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3,c中先有浑浊产生,后又变澄清,此浑浊物为S,故答案为:S;
(4)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,再关闭K2打开K1,防止拆除装置时污染空气,故答案为:NaOH溶液;关闭K2打开K1;
【实验二】(5)①硝酸银溶液显酸性,应该用酸式滴定管盛装;Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀半分钟内沉淀不消失,说明反应到达滴定终点,故答案为:酸式滴定管;滴入最后一滴硝酸银溶液,出现淡黄色沉淀,半分钟内沉淀不消失;
②消耗AgNO3的物质的量为1.5×10-3L×0.0001mol/L=1.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为1.50×10-7mol×2×49g/mol=1.47×10-5g,废水中氰化钠的含量为![]() =0.735mg/L>0.50mg/L,处理后的废水未达到达到排放标准,故答案为:否。
=0.735mg/L>0.50mg/L,处理后的废水未达到达到排放标准,故答案为:否。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】氯磺酰氰酯(结构简式为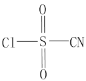 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为__________,组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为__________
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是__________、__________, 1个氯磺酰氰酯分子中含有σ键的数目为__________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为__________。
(3)ClO4-的空间构型为__________
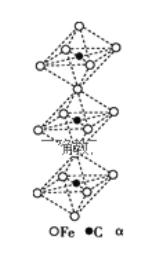
(4)一种由铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图或曲线图与对应的叙述相符的是
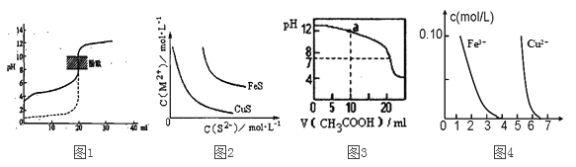
A. 如图1所示,用0.1mol/LNaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
B. 某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵坐标c(M2+)代表Fe2+或Cu2+的浓度,横坐标c(S2—)代表S2—浓度。在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+
C. 如图3所示,用0.1mol/LCH3COOH溶液滴定20mL0.1mol/LNaOH溶液的滴定曲线,当pH=7时:c(Na+)=c(CH3COO—)>c(OH—)=c(H+)
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5.5左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置(固定、加热仪器和橡胶管略)进行有关氨制取的实验探究。回答下列问题:
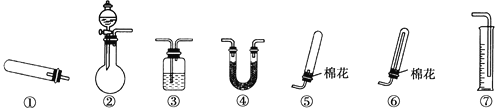
(1)若用装置①制取NH3,其反应的化学方程式为__________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是________。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂可能是__,分液漏斗中装的试剂可能是________,收集装置应选择________(填装置序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以将反应Zn+Br2ZnBr2设计成蓄电池,有下列四个电极反应:①Br2+2e==2Br ②2Br2e== Br2 ③Zn2e==Zn2+ ④Zn2+ +2e== Zn,其中表示放电时的正极反应(即充电时的阳极)和放电时的负极反应的分别是
A. ②和③B. ②和①C. ③和①D. ④和①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于人体所需的基本营养物质的说法不正确的是( )
A. 在人体内,油脂的主要反应是在脂肪酶催化下水解为高级脂肪酸和甘油
B. 加酶洗衣粉中的酶其实是蛋白质
C. 糖类都由C、H、O三种元素组成
D. 糖类、油脂、蛋白质都能在一定条件下发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
已知HCO3-+AlO2-+H2O==CO32-+Al(OH)3↓。将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为
A.  B.
B.  C.
C.  D.
D. 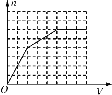
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从物质A开始有如下图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
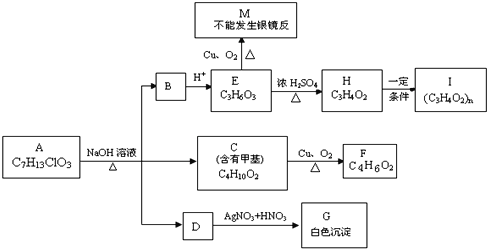
(1)A可能的结构简式:_______________________________________________;
(2)写出反应类型: E→H_________________、H→I__________________;
(3)写出C→F的化学方程式:__________________________。
(4)请设计出由丙烯合成CH3-CH(OH)-COOH的反应流程图_______(有机物用结构简式表示,必须注明反应条件)。提示:合成过程中无机试剂任选。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A. 能生成碱的金属元素都在ⅠA族
B. 稀有气体元素原子的最外层电子数均为8
C. 第二周期ⅣA族元素的原子核电荷数和中子数一定为6
D. 原子序数为14的元素位于元素周期表的第3周期ⅣA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com