
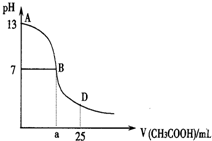
 如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )| A. | c(OH-)大于、小于或等于c(CH3COO-) | B. | c(OH-)一定等于c(CH3COO-) | ||
| C. | c(OH-)一定小于c(CH3COO-) | D. | c(OH-)一定大于c(CH3COO-) |
分析 在AB区间内,包括醋酸和氢氧化钠恰好完全反应和醋酸不足氢氧化钠溶液过量溶液显碱性两种可能,当氢氧化钠溶液和醋酸恰好反应时,溶液显碱性,此时生成的溶液可能为醋酸钠,c(OH-)小于c(CH3COO-);当氢氧化钠溶液和醋酸反应后剩余氢氧化钠溶液,溶液仍然显碱性,此时若剩余的氢氧化钠量很大,则c(OH-)大于c(CH3COO-).
解答 解:向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线,在AB区间内,c(OH-)>c(H-),说明溶液显碱性,当氢氧化钠溶液和醋酸恰好反应时,溶液显碱性,此时生成的溶液可能为醋酸钠,c(OH-)小于c(CH3COO-);当氢氧化钠溶液和醋酸反应后剩余氢氧化钠溶液,溶液仍然显碱性,此时若剩余的氢氧化钠量很大,则c(OH-)大于c(CH3COO-),也有可能剩余的氢氧化钠和醋酸钠中醋酸根水解之后剩余的醋酸根的浓度相等;
故选A.
点评 本题是一道有关溶液混合后离子浓度的大小比较问题,难度中等,考查学生分析和解决问题的能力.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题

| 0.1 | 0.5 | 1 | 10 | |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化铵溶液中滴加浓盐酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7 | |
| D. | 将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+ )=3[c(HC2O4- )+c(C2O42-)+c(H2C2O4)] | |
| B. | pH=4.3的NaHC2O4溶液中:c(Na+ )>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 0.10mol•L-1NaHCO3溶液中:c(Na+ )+c(H+ )=c(OH- )+c(HCO3-)+c(CO32-) | |
| D. | 0.10mol•L-1 NaHCO3溶液加水稀释后,n(H+ )与n(OH- )的乘积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
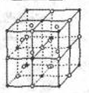 Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题:
Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 核外电子总是先排在能量低的电子层上 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
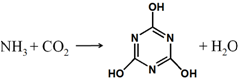 CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含有σ键又含有π键 | ||
| C. | 分子中既含极性键,又含非极性键 | D. | 生成该物质的上述反应为中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<D<C<B | |
| B. | 最简单氢化物的稳定性:D<C | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com