
【题目】烟气中含有大量氮氧化物NOx,工业脱硝技术成为研究热点。
(1)汽车尾气中NO和CO可利用车载催化剂转化为无毒物质排放。
已知:N2(g)+O2(g)=2NO(g) △H1=+183 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565 kJ·mol-1
写出催化转化的热化学方程式_________。
(2)臭氧氧化-碱吸收法可有效脱除NO,氧化原理为:NO(g)+O3(g)![]() NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。
NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。

①100℃时,从开始反应到P点的平均反应速率v(NO)=__________。
②反应时同时发生副反应:2O3![]() 3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
(3)选择性催化还原技术(NCR)可在较低温度下脱硝,原理如图I,天然锰矿可作催化剂。

以NO代表氮氧化物,写出反应方程式_____________________;实验测得脱硝率随温度的变化如图II所示,请分析温度高于250℃时脱硝率下降的原因可能是______________。
【答案】2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=—748 kJ/mol 0.0425mol/(L·min) 0.855 4NH3+6NO![]() 5N2+6H2O 温度升高,NH3发生副反应或升高温度,催化剂的活性降低或该反应为放热反应,升高温度,平衡向逆反应方向移动
5N2+6H2O 温度升高,NH3发生副反应或升高温度,催化剂的活性降低或该反应为放热反应,升高温度,平衡向逆反应方向移动
【解析】
(1)由盖斯定律计算可得;
(2)①由化学反应速率公式计算可得;
②反应中与NO反应和自身分解均消耗O3;
(3)由图可知,脱硝的反应原理为氮的氧化物与氨气在催化剂作用下共热反应生成氮气和水。
(1)将已知反应依次编号为①②,由盖斯定律可知②-①得到NO转化为无毒气体的热化学反应方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g),则△H=(-565kJ/mol)—(+183 kJ/mol)=—748 kJ/mol,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=—748 kJ/mol;
(2)①由图可知,100℃时,P点NO的转化率为85%,则消耗NO的浓度为![]() =0.425mol/L,则从开始反应到P点的平均反应速率v(NO)=
=0.425mol/L,则从开始反应到P点的平均反应速率v(NO)=![]() =0.0425mol/(L·min),故答案为:0.0425mol/(L·min);
=0.0425mol/(L·min),故答案为:0.0425mol/(L·min);
②由方程式可知,与NO反应的O3的物质的量为1.0mol×85%=0.85mol,自身分解为O2的O3的物质的量为2.0mol×15%=0.3mol,则P点时O3的物质的量为(2.0mol—0.85mol—0.3mol)=0.85mol,故答案为:0.85;
(3)由图可知,脱硝的反应原理为氮的氧化物与氨气在催化剂作用下共热反应生成氮气和水,则以NO代表氮氧化物的反应方程式为4NH3+6NO![]() 5N2+6H2O;温度高于250℃时脱硝率下降的原因可能是温度升高,NH3发生副反应导致脱硝率下降或升高温度,催化剂的活性降低导致脱硝率下降或该反应为放热反应,升高温度,平衡向逆反应方向移动导致脱硝率下降,故答案为:4NH3+6NO
5N2+6H2O;温度高于250℃时脱硝率下降的原因可能是温度升高,NH3发生副反应导致脱硝率下降或升高温度,催化剂的活性降低导致脱硝率下降或该反应为放热反应,升高温度,平衡向逆反应方向移动导致脱硝率下降,故答案为:4NH3+6NO![]() 5N2+6H2O;温度升高,NH3发生副反应或升高温度,催化剂的活性降低或该反应为放热反应,升高温度,平衡向逆反应方向移动。
5N2+6H2O;温度升高,NH3发生副反应或升高温度,催化剂的活性降低或该反应为放热反应,升高温度,平衡向逆反应方向移动。


科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量CO2) 直接制备二甲醚,其中的主要过程包括以下四个反应:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ·mol-1
CH3OH(g) ΔH1=-90.1kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH3=+41.1kJ·mol-1
④2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1。试回答下列问题:
CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1。试回答下列问题:
(1)由H2和CO直接制备二甲醚的热化学方程式:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH =_______kJ·mol-1;该反应可以自发进行的条件为________________。
CH3OCH3(g)+H2O(g) ΔH =_______kJ·mol-1;该反应可以自发进行的条件为________________。
(2)将1.0mol CO2 和 3.0mol H2 充入2L恒容密闭容器中,使其仅按反应②进行,在不同催化剂作用下,相同时间内 CO2 的转化率随温度变化如图所示。下列说法正确的是______________
A.T3对应的平衡常数小于T4对应的平衡常数
B.根据图中曲线分析,催化剂I的催化效果最好
C.b点v(正)可能等于v(逆)
D.a点的转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低
(3)若CO2和H2仅发生反应②和③,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按 n(CO2):n(H2)=1:3(总量为a mol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的 CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
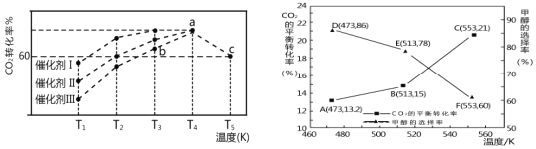
①在553K达到平衡时,反应体系内甲醇的物质的量为_________mol。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:____________________________ 。
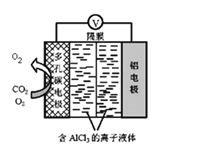
(4)O2催化辅助的 Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。 则电池的正极反应式:6O2+6e-=6O2-和____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol/LNaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数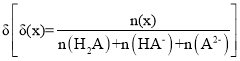 如图所示:
如图所示:
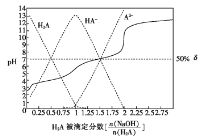
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1NaA溶液中: ![]()
C.0.1 mol·L-1NaHA溶液中: ![]()
D.H2A 的K2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下CH3COOH和NH3·H2O的电离常数均为1.8×10-5。某小组进行如图三组实验且实验II、III中Mg(OH)2固体均溶解。下列说法正确的是
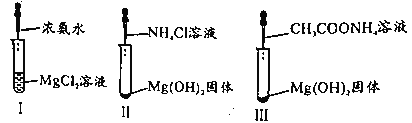
A.I中现象说明NH3·H2O碱性强于Mg(OH)2
B.II中总反应为2H++Mg(OH)2=Mg2++2H2O
C.实验II、III研究NH4+对Mg(OH)2溶解的作用原理
D.III中CH3COONH4浓度越小,越有利于沉淀的溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L的烧瓶中充入一定量N2O4气体。
(1)体系中气体颜色由浅变深,写出对应的化学方程式____________________。
(2)保持温度和容积不变,向达到平衡的容器中再充入一定量N2O4气体,平衡________移动(填“正向”、“逆向”或“不”),N2O4的转化率___________(填“增大”、“减小”或“不变”,下同),反应的平衡常数___________。
(3)某小组为研究温度对化学平衡移动的影响,设计如图实验。图方案还需补充的是_____________(用文字表达);实验现象为______________________。
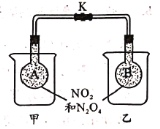
(4)在一定条件下,N2O4和NO2的消耗速率与压强关系为:v(N2O4)=k1·c(N2O4),v(NO2)=k2·c(NO2),设达到平衡时c(N2O4)=1 mol/L,则(1)中反应的平衡常数为_________(用k1、k2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 的叙述错误的是( )
的叙述错误的是( )
A.是两性氢氧化物
B.是难溶于水的白色胶状物质,是弱电解质
C.既溶于氨水,又能溶于醋酸
D.能凝聚水中悬浮物,可用做净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】傅克反应是合成芳香族化合物的一种重要方法。有机物a(-R为烃基)和苯通过傳克反应合成b的过程如下(无机小分子产物略去)

下列说法错误的是
A. 一定条件下苯与氢气反应的产物之一环己烯与螺[2.3]己烷![]() 互为同分异构体
互为同分异构体
B. b的二氯代物超过三种
C. R为C5H11时,a的结构有3种
D. R为C4H9时,1molb加成生成C10H20至少需要3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示。已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物物的沸点如下表:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
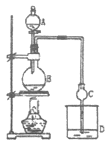
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液,经分液漏斗边滴加醋酸、边加热。
请回答:
(1)反应混合物的配制:圆底烧烧瓶中先加入___,再逐滴加入___,边加边振荡,___后,再加入醋酸。
(2)反应中加入的乙醇是过量的,其目的是___;浓硫酸的作用:①___;②___。
(3)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为___。
(4)加热除了加快反应速率外还有一个重要的目的:___。
(5)在装置中,球形干燥管主要起到两个作用:一是起冷凝作用,二是:___。
(6)试管中盛放的是饱和碳酸钠溶液,它的作用是___(选填编号)。
A.中和乙酸和乙醇 B.吸收乙酸并溶解乙醇
C.降低乙酸乙酯的溶解度,有利于析出 D.加速乙酸乙酯的生成,提高其产率
(7)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___;再加入___(此空从下列选项中选择),目的是___,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.碱石灰 B.无水硫酸钠 C.生石灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com