
分析 (1)根据物质导电的原因分析,只要含有自由移动的离子或自由电子即可;
(2)根据电解质的定义分析,在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
(3)非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(4)在水溶液中能够完全电离的电解质是强电解质;
(5)在水溶液中能够部分电离的电解质是强电解质.
解答 解:①水是化合物,含有自由移动离子能够导电,部分电离,属于弱电解质;
②NaCl溶液,含有自由移动离子能够导电,是混合物,既不是电解质也不是非电解质;
③硫酸不含有自由移动离子或者自由电子,不导电,溶于水能够完全电离而导电,属于电解质中的强电解质;
④SO2不含有自由移动离子或者自由电子,不导电,本身不能电离产生自由离子,属于非电解质,溶于水,与水反应生成亚硫酸,亚硫酸能电离产生自由离子而导电;
⑤BaSO4(熔融态)含有自由移动离子,能导电,硫酸钡熔融状态下能够完全电离,属于电解质中的强电解质;
⑥酒精不含有自由移动离子或者自由电子,不导电,在水溶液里和熔融状态下都不能导电的化合物,是非电解质;
⑦NaOH晶体不含有自由移动离子或者自由电子,不导电,在水溶液里和熔融状态下都能完全电离而导电,属于电解质中的强电解质;
⑧铁片含有自由电子而导电,属于单质,既不是电解质,也不是非电解质,不溶于水;
⑨盐酸含有自由移动离子能够导电,是混合物既不是电解质,也不是非电解质;
⑩氨水含有自由移动离子能够导电,是混合物,既不是电解质也不是非电解质;
所以:能导电的是①②⑤⑧⑨⑩;溶于水后能导电的是①③④⑦;属于电解质的是①③⑤⑦;属于非电解质的④⑥;属于强电解质的是③⑤⑦,属于弱电解质的是①;
故答案为:①②⑤⑧⑨⑩;①③④⑦;①③⑤⑦;④⑥;③⑤⑦;①.
点评 本题考查了电解质、非电解质、强电解质的判断,熟悉相关概念是解题关键,注意单质、混合物既不是电解质也不是非电解质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下1molO2与其他物质发生反应时转移的电子数一定为4NA | |
| B. | 1L 0.1 mol/L的Na2CO3溶液中,Na+、CO32-总数为0.3 NA | |
| C. | 28g C18O中含有的质子数为14 NA | |
| D. | 锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4L,锌失去电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
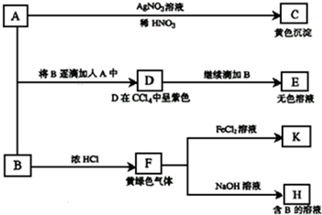
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应A(g)+B(g)═2C(s)可以自发进行,则其必为放热反应 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
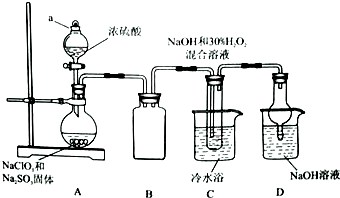 实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.
实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接做阴极 | |
| B. | 在pH<5的溶液中,金属主要发生析氢腐蚀 | |
| C. | 钢铁制品吸氧腐蚀时正极反应为:O2+2H2O+4e-=4OH- | |
| D. | 在金属物件表面涂上机油可防止金属生锈从而使金属保持光泽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com