
有一种铁的氧化物,质量为0.4g, 在加热的条件下,用足量的一氧化碳还原,把生成的二氧化碳通入足量澄清的石灰水,得到0.75g沉淀.则这种铁的氧化物的化学式为
| A.FeO | B. Fe3O4 | C. Fe2O3 | D.Fe4O5 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
![]() —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
以![]() —锂辉石为原料制备碳酸锂的一种流程如下:
—锂辉石为原料制备碳酸锂的一种流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
回答下列问题:
(1)反应II中加碳酸钙的作用是 。
(2)写出反应III中生成沉淀A的离子方程式 、 。
(3)写出反应IV的化学方程式 。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是 。
(4)实验室中常用于蒸发浓缩的硅酸盐质的仪器有______________。
A、蒸发皿 B、玻璃棒 C、铁架台(带铁圈) D、酒精灯 E、圆底烧瓶
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省资阳市高三第二次诊断考试理综化学试卷(解析版) 题型:填空题
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
元 素 性 质
A 一种核素的原子核内不含中子
B 原子核外电子有6种不同运动状态
C 最高价氧化物的水化物与其氢化物可发生非氧化还原反应
D 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线
E 在地壳中的含量位居第三
F 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍
G 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨
根据以上信息,回答下列问题:
(1)画出元素C的基态原子核外电子排布图:____;D、E、F三种元素的第一电离能大小顺序为:____(用元素符号表示)。
(2)化合物BA2D2蒸气293 K时,理论测算密度为1.9 g·L-1,实际密度为2.5 g·L-1的原因是___。
(3)FD2中F原子的杂化类型为______;分子空间构型为______;FD2易溶于水的原因可能是:_____(填入序号)。
①FD2与水极性相同 ②FD2可以与水反应
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:______。
(5)D、E形成的一种化合物硬度仅次于金刚石,主要用作高级研磨材料、制作手表的轴承,该物质晶体类型是______晶体。另一含有E的硫酸盐是一种常用净水剂,其水溶液呈_______(选填:“酸性”、 “中性”、“碱性”),原因是: ______(用离子方程式解释)。
(6)化合物M可用于制备一种“绿色”环保高效净水剂K2FeO4(高铁酸钾)。补充完整并配平该制备反应的化学方程式:□____+□KNO3+□____=□K2FeO4+□KNO2+□H2O
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都市高三第二次诊断性考试理综化学试卷(解析版) 题型:填空题
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂 BAC〔Al2(OH)nCl6-n〕的流程如下:
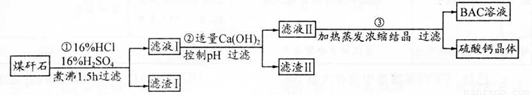
(1)粉碎煤矸石的目的是______;滤渣I的主要成分是______ (填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中有色离子为______ (填 化学式);随后溶液又变为棕黄色,相关离子反应方程式为______;
步骤①的煮沸装置上方需安装一长导管,长导管的作用是____________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是___________ ;巳 知BAC的分散质粒子大小在1 nm〜100 nm之间,由此区别滤液I与BAC两种液体的物理方法是______;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式______。
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5℅水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源:2010年广东省汕头市理综化学考前押题卷 题型:实验题
 —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
以 —锂辉石为原料制备碳酸锂的一种流程如下:
—锂辉石为原料制备碳酸锂的一种流程如下:
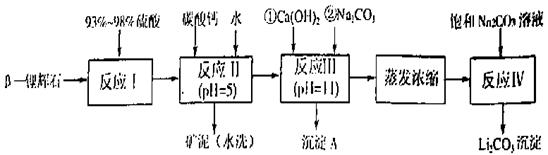
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
2.7 |
3.7 |
9.6 |
|
完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度的溶解度如下表:
|
温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
|
Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
回答下列问题:
(1)反应II中加碳酸钙的作用是 。
(2)写出反应III中生成沉淀A的离子方程式 、 。
(3)写出反应IV的化学方程式 。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是 。
(4)实验室中常用于蒸发浓缩的硅酸盐质的仪器有______________。
A、蒸发皿 B、玻璃棒 C、铁架台(带铁圈) D、酒精灯 E、圆底烧瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com