
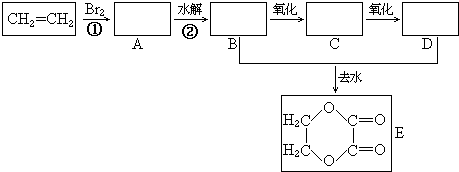
 +2H2O.
+2H2O.分析 乙烯与溴发生加成,则A为BrCH2CH2Br,水解生成B,则B为HOCH2CH2OH,B氧化生成C,C为OHC-CHO,C氧化生成D,则D为HOOC-COOH,B与D发生酯化反应生成E,然后结合有机物的结构和性质来解答.
解答 解:乙烯与溴发生加成,则A为BrCH2CH2Br,水解生成B,则B为HOCH2CH2OH,B氧化生成C,C为OHC-CHO,C氧化生成D,则D为HOOC-COOH,B与D发生酯化反应生成E,
(1)根据上面的分析可知,①的反应类型 加成反应,反应②为卤代数烃的碱性水解,所以反应条件是氢氧化钠水溶液、加热,
故答案为:加成反应;氢氧化钠水溶液、加热;
(2)根据上面的分析可知,C为OHC-CHO,D为HOOC-COOH,
故答案为:OHC-CHO;HOOC-COOH;
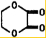
(3)B和D反应生成E的化学方程式为CH2OHCH2OH+HOOC-COOH$?_{△}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为:CH2OHCH2OH+HOOC-COOH$?_{△}^{浓硫酸}$ +2H2O;
+2H2O;
(4)B为HOCH2CH2OH,所以B核磁共振氢谱表明其有2个不同化学环境的氢,且峰面积比为2:1(或1:2),
故答案为:2;2:1(或1:2).
点评 本题考查有机物的合成,题目难度不大,注意把握常见有机物的性质以及反应条件和反应类型,为中学阶段考试热点问题,在学习中注意积累.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 可逆反应只是代表少数反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①⑤⑥ | C. | 只有②④⑥ | D. | 只有③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH、NH4HCO3都属于电解质 | |
| B. | 铝热剂、水玻璃、氨水均为混合物 | |
| C. | 铝、铁对应的氧化物均为碱性氧化物 | |
| D. | 溶液和胶体的本质区别是丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com