
| A. | 是直链烃,但分子中3个碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比丁烷沸点高 | |
| D. | 1 mol丙烷完全燃烧消耗5 mol O2 |
分析 A.烷烃分子中有多个碳原子应呈锯齿形,丙烷中3个C呈V形;
B.丙烷等烷烃在光照的条件下可以和氯气发生取代反应;
C.烷烃中碳个数越多沸点越高;
D.根据丙烷燃烧方程式C3H8+5O2$\stackrel{点燃}{→}$3CO2+4H2O来计算.
解答 解:A.烷烃分子中有多个碳原子应呈锯齿形,丙烷中3个C呈V形,3个碳原子不在一条直线上,故A正确;
B.丙烷等烷烃在光照的条件下可以和氯气发生取代反应,生成氯代烷和HCl,故B正确;
C.烷烃中碳个数越多沸点越高,丙烷分子中碳原子数小于丁烷,故丁烷沸点高,更易液化,故C错误;
D.由丙烷燃烧方程式C3H8+5O2$\stackrel{点燃}{→}$3CO2+4H2O可知,1 mol丙烷完全燃烧消耗5 mol O2,故D正确;
故选C.
点评 本题主要考查烷的结构与性质等,题目难度较小,注意基础知识的积累,把握烷烃的取代反应和燃烧反应是解题的关键,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金属钠和水反应 | B. | 生石灰变成熟石灰的反应 | ||
| C. | Al和Fe2O3的铝热反应 | D. | CaCO3受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | O2和O3互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 原因分析 |
| A | 久置的浓硝酸呈黄色 | 浓硝酸不稳定,分解生成的NO2 溶解在其中 |
| B | 铝片先用砂纸打磨,再加入到浓硝酸中,无明显现象 | 浓硝酸具有强氧化性,常温下,铝被浓硝酸钝化 |
| C | SO2通入酸性高锰酸钾溶液中,溶液紫红色褪去 | SO2具有漂白性,使其褪色 |
| D | 向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 | 在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成了CO2、SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1•S-1 | B. | 0.4 mol•L-1•S-1 | C. | 0.6mol•L-1•S-1 | D. | 0.8 mol•L-1•S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
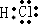 ,X2Y的结构式
,X2Y的结构式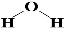 .
.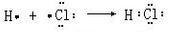 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com