
下列关于离子的叙述正确的是( )
|
| A. | 在c(H+)=1×10﹣13mol•L﹣1的溶液中:Na+、Fe3+、Cl﹣、SO42﹣能大量共存 |
|
| B. | 铜溶于FeCl3溶液中:Cu+Fe3+=Fe2++Cu2+ |
|
| C. | NaHCO3溶液中:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) |
|
| D. | 向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,说明该溶液中一定含有SO42﹣ |
| 离子共存问题;离子方程式的书写;离子浓度大小的比较;硫酸根离子的检验.. | |
| 分析: | A.该溶液为碱性溶液,铁离子与氢氧根离子反应生成氢氧化铁沉淀; B.离子方程式两边正电荷不相等,不满足电荷守恒; C.根据碳酸氢钠溶液中的物料守恒判断; D.原溶液中可能存在银离子,不一定存在硫酸根离子. |
| 解答: | 解:A.在c(H+)=1×10﹣13mol•L﹣1的溶液中存在大量氢氧根离子,Fe3+、OH﹣之间发生反应生成氢氧化铁沉淀,在溶液中不能大量共存,故A错误; B.铜溶于FeCl3溶液中生成亚铁离子和铜离子,正确的离子方程式为:Cu+2Fe3+=2Fe2++Cu2+,故B错误; C.NaHCO3溶液中,根据物料守恒可得:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3),故C正确; D.向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,该白色沉淀可能为氯化银,原溶液中可能存在银离子,不一定含有SO42﹣,故D错误; 故选C. |
| 点评: | 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH﹣;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
硫及其部分化合物的转化关系如图所示。
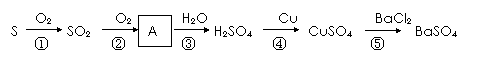 |
(1)硫单质俗称硫黄,通常状况下硫单质的颜色为 ;
(2)SO2可以使品红溶液褪色,说明SO2具有 (填“漂白性”或“氧化性”);
(3)化合物A的化学式为 ;
(4)反应⑤的离子方程式为 ;
(5)反应④中,当32g Cu完全反应时,被还原的H2SO4的物质的量为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的
N(C):N(H)=1:2
B.一种烃在足量的氧气中完全燃烧后的产物通过碱石灰,减少的体积就是生成的
二氧化碳的体积(温度>100℃)
C.某气态烃CxHy与足量O2完全反应,如果反应前后气体体积不变(温度<100℃),
则y=4;若体积减少,则y<4;否则y>4
D.相同质量的烃,完全燃烧,消耗O2越多,烃分子中C、H原子个数比越大
查看答案和解析>>
科目:高中化学 来源: 题型:
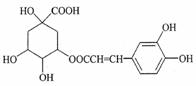 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示。关于咖啡鞣酸的下列说法正确的是
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示。关于咖啡鞣酸的下列说法正确的是
A.分子式为C16H18O9
B.1mol咖啡鞣酸水解时可消耗8molNaOH
C.咖啡鞣酸分子中所有原子都在同一平面上
D.与浓溴水既能发生取代反应又能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,他因此获得了1918年诺贝尔化学奖。其合成原理为: N2(g)+3H2(g)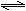 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:
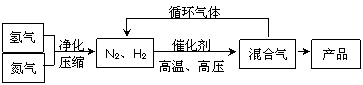

回答下列问题:
(1)已知299 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) △H=-Q kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失) ▲
2NH3(g) △H=-Q kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失) ▲
A.一定大于Q kJ B.一定等于Q kJ C.一定小于Q kJ D. 不能确定
(2)已知反应:①N2(g) + O2(g) = 2NO(g) △H1=+180.5kJ/mol
②4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H2=-905kJ/mol
③2H2(g) + O2(g) = 2H2O(g) △H3=-483.6kJ/mol
则N2(g)+3H2(g) 2NH3(g)的△H = ____________▲ ______________。
2NH3(g)的△H = ____________▲ ______________。
(3)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为: ▲ 。
(4)一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+
2NH3+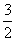 O2 进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):请回答下列问题:
O2 进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):请回答下列问题:
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
①50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为_____▲ mol·h-1。
②该反应过程与能量关系可用如图表示,则反应的热化学方程式是__________________________▲________________________________________________。
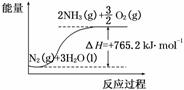
③工业合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g),在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。该条件下的平衡常数为___▲____;
2NH3(g),在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。该条件下的平衡常数为___▲____;
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来大气问题受到人们越来越多的关注.按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义.在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图1.
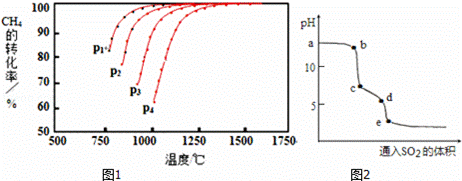
则p1、p2、p3、p4由大到小的顺序 P4>P3>P2>P1 ,该反应的正反应是 吸热 (填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K= 1024 .
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1
CH4(g)+2NO2 (g)=N2(g)+CO2(g)+2H2O(g)△H3
则△H3= ﹣867kJ•mol﹣1 ,如果三个反应的平衡常数依次为K1、K2、K3,则K3= 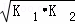 (用K1、K2表示)
(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol•L﹣1NaOH溶液通入SO2过程中的pH变化曲线如图2所示.
①ab段发生反应的离子方程式为 SO2+2OH﹣=SO32﹣+H2O .
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为 c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣) ,如果NaHSO3的水解平衡常数Kh=1×10﹣12mol•L﹣1,则该温度下H2SO3的第一步电离平衡常数Ka= 10﹣2mol•L﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
Li和Na都是IA族元素,关于这两种元素的原子说法正确的是 ( )
A.原子半径:Li>Na B.最外层电子数都相同
C.核外电子层数相同 D.核外电子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为 。D在周期表中位置 。
(2)写出E的电子式: 。
(3)A、D两元素形成的化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A为造纸的原料之一,是一种天然的高分子化合物,D为一种具有水果香味的液体。它们之间的转化关系如下图。
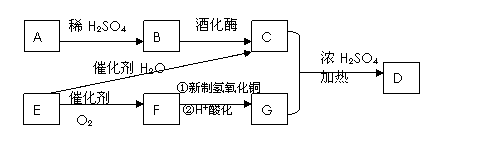

(1)请写出D的结构简式 ,B的官能团名称为 。
(2)写出下列反应的化学方程式,并指明反应类型。
E→C: 反应类型
F→G(与新制氢氧化铜的反应): 反应类型
(3)E常用于制备一种高分子材料,这种高分子化合物的结构简式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com