
【题目】某化学研究性学习小组为了制取焦亚硫酸钠(![]() ),并对其性质进行研究。特进行如下实验:
),并对其性质进行研究。特进行如下实验:
实验一 制取焦亚硫酸钠。
研究小组采用下图装置(实验前已除尽装置内的空气)制取![]() 。装置Ⅱ中有
。装置Ⅱ中有![]() 晶体析出,发生的反应为:
晶体析出,发生的反应为:![]() 。
。
(1)装置Ⅰ中通常采用70%~80%的浓硫酸与亚硫酸钠固体反应制取![]() ,而不用98%的浓硫酸或极稀的稀硫酸,原因是________________________。
,而不用98%的浓硫酸或极稀的稀硫酸,原因是________________________。
(2)若要从装置Ⅱ中获得已析出的晶体,所采取的分离方法需用到的玻璃仪器有________。
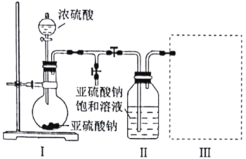
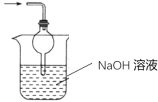
(3)装置Ⅲ用于处理尾气,请画出用来处理尾气并防止发生倒吸的实验装置,注明相应的试剂。
____________________________________________________________
(4)已知![]() 溶于水后,立即生成
溶于水后,立即生成![]() ,该反应的离子方程式为________________________。
,该反应的离子方程式为________________________。
(5)用![]() 试纸测得
试纸测得![]() 溶液呈酸性,其溶液呈酸性的原因是________________________。
溶液呈酸性,其溶液呈酸性的原因是________________________。
(6)取少量焦亚硫酸钠晶体于试管中,其中滴加酸性![]() 溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生
溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生![]() ,该反应的离子方程式是________________________。
,该反应的离子方程式是________________________。
实验三 焦亚硫酸钠的含量测定。
测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。
已知:![]() ;
;![]() 。
。
①精确称取干燥的产品![]() 放入碘量瓶(带磨口塞的锥形瓶)中。
放入碘量瓶(带磨口塞的锥形瓶)中。
②向碘量瓶中准确移取![]() ,
,![]() 的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
③加入![]() 淀粉溶液,用标准
淀粉溶液,用标准![]() 溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为
溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为![]() 。
。
(7)上述实验操作滴定终点的现象为________________________;根据上述实验,计算产品中焦亚硫酸钠的质量分数为________________________。
【答案】98%的浓硫酸以分子存在,不能提供![]() ,浓度极稀的稀硫酸会使反应产生的
,浓度极稀的稀硫酸会使反应产生的![]() 部分溶解在其中,造成损耗 烧杯、漏斗、玻璃棒
部分溶解在其中,造成损耗 烧杯、漏斗、玻璃棒 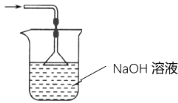
![]()
![]() 的电离程度大于水解程度
的电离程度大于水解程度 ![]() 当滴入最后一滴
当滴入最后一滴![]() 溶液时,溶液由蓝色变为无色,且半分钟内不恢复 76%
溶液时,溶液由蓝色变为无色,且半分钟内不恢复 76%
【解析】
(1)98%的浓硫酸中硫酸主要以分子形式存在,氢离子浓度小,反应速率慢,二氧化硫易溶于水,硫酸浓度过小,不利于二氧化硫逸出;
(2)过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)二氧化硫有毒会污染环境,装置Ⅲ为尾气处理装置,用氢氧化钠溶液吸收未反应的二氧化硫,同时用倒置的漏斗或干燥管防止产生倒吸;
(4)由题意可知Na2S2O5溶于水后,立即生成NaHSO3;
(5)用![]() 试纸测得NaHSO3溶液呈酸性,说明溶液中HSO3-的电离程度大于水解程度;
试纸测得NaHSO3溶液呈酸性,说明溶液中HSO3-的电离程度大于水解程度;
(6)焦亚硫酸钠与酸性高锰酸钾溶液发生氧化还原反应生成硫酸钠、硫酸锰和水;
(7)滴硫代硫酸钠溶液过量时溶液由蓝色变为无色;依据化学方程式计算可得。
(1)装置Ⅰ中亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,98%的浓硫酸中硫酸主要以分子形式存在,氢离子浓度小,反应速率慢,二氧化硫易溶于水,硫酸浓度过小,不利于二氧化硫逸出,故答案为:98%的浓硫酸以分子存在,不能提供H+,浓度极稀的稀硫酸会使反应产生的SO2部分溶解在其中,造成损耗;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态应采取过滤方法进行分离,过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(3)二氧化硫有毒会污染环境,装置Ⅲ为尾气处理装置,用氢氧化钠溶液吸收未反应的二氧化硫,同时用倒置的漏斗或干燥管防止产生倒吸,实验装置为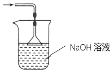 或
或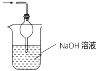 ,故答案为:
,故答案为: 或
或 ;
;
(4)由题意可知Na2S2O5溶于水后,立即生成NaHSO3,反应的离子方程式为S2O52—+ H2O=2 HSO3—,故答案为:S2O52—+ H2O=2 HSO3—;
(5)用![]() 试纸测得NaHSO3溶液呈酸性,说明溶液中HSO3-的电离程度大于水解程度,故答案为:HSO3-的电离程度大于水解程度;
试纸测得NaHSO3溶液呈酸性,说明溶液中HSO3-的电离程度大于水解程度,故答案为:HSO3-的电离程度大于水解程度;
(6)由题意可知,焦亚硫酸钠与酸性高锰酸钾溶液发生氧化还原反应生成硫酸钠、硫酸锰和水,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(7)由题意可知,当滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且半分钟内不恢复说明达到滴定终点;由方程式可得2n(S2O52—)+![]() (S2O32-)=2(I2),n(S2O52—)=
(S2O32-)=2(I2),n(S2O52—)=![]() ×(1×10—2-
×(1×10—2-![]() ×1.68×10—2)mol=8×10—3mol,则焦亚硫酸钠的质量分数为
×1.68×10—2)mol=8×10—3mol,则焦亚硫酸钠的质量分数为![]() ×100%=76%,故答案为:当滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且半分钟内不恢复;76%。
×100%=76%,故答案为:当滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且半分钟内不恢复;76%。


科目:高中化学 来源: 题型:
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在 200℃和 10MPa 的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4 和 CH3OH 的燃烧热分别 784kJ/mol 和 628kJ/mol 则 2CH4(g)+O2(g)![]() 2CH3OH(g) △H=_____。
2CH3OH(g) △H=_____。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g) +H2O(g) △H<0。某温度下,,将 2.0molCO(g)和 6.0molH2(g)充入容积为 2L 的密闭容器中,反应到达平衡时, 改变压强和温度,平衡体系中 CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是_____。
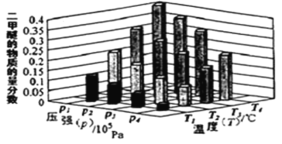
A.p3>p2,T3>T2
B.p1>p3,T1>T3
C.p1>p4,T2>T3
D.p2>p4,T4>T2
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g);
2CO2(g) +N2(g);
①200K、pPa时,在一个容积为 2L的恒温密闭容器中充入 1.5molNO 和 2.0molCO,开始反应至 2min 时测得 CO 转化率为 30%,则用N2表示的平均反应速率为v(N2)=_________;反应达到平衡状态时,测得二氧化碳为 0.8mol,则平衡时的压强为起始压强的_________倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH_____0(填“>”、“<”)
(4)一定温度下,将NO2与SO2以体积比 1:2 置于密闭容器中发生反应NO2(g)+SO2(g) SO3(g)+NO(g),达到平衡时SO3的体积分数为 25%。该反应的平衡常数K= ______。
(5)利用原电池反应可实现NO2 的无害化,总反应为6NO2+ 8NH3=7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池正极区附近溶液 pH ____(填“变大”、“变小”或“不变”),负极电极反应式为 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,包含颗粒物(PM2.5)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染问题中有着重要的作用。
(1)已知:①2CO(g)+O2(g)=2CO2(g)△H1=-566.0kJ·mol-1
②N2(g)+2O2(g)=2NO2(g)△H2=+64kJ·mol-1
反应2NO2(g)+4CO(g=N2(g)+4CO2(g)在__________(填“高温”或“低温”)条件下能自发进行。
(2)研究发现利用NH3可除去硝酸工业尾气中的NO。NH3与NO的物质的量之比分别为1:2、1:1.5、3:1时,NO脱除率随温度变化的曲线如图1所示。

①曲线a中,NO的起始浓度为6×10-4mg·m-3,若从X点到Y点经过20s,则该时间段内NO的脱除速率为_________mg·m-3·s-1。
②曲线c对应的NH3与NO的物质的量之比是________,其理由是__________
(3)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化氧可以快速氧化SO2。活化过程中的能量变化模拟计算结果如图2所示。无水情况下,一个氧分子的活化能为__________,容易活化氧分子的条件是_________(填“有水”或“无水”)。
(4)若反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的正、逆反应速率分别可表示为v正=k正c2(NO)·c2(CO);v逆=k逆c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molNO和4molCO发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图3所示。
N2(g)+2CO2(g)的正、逆反应速率分别可表示为v正=k正c2(NO)·c2(CO);v逆=k逆c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molNO和4molCO发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图3所示。

①a点时,v逆:v正=_____________。
②测得平衡时体系压强为p,KP为用气体分压表示的平衡常数,分压=总压×物质的量分数,则平衡常数KP=____________(用含p的式子表示)。
(5)某研究小组探究该反应中催化剂对脱氮率(NO的转化率)的影响。将等物质的量的NO和CO以一定的流速分别通过催化剂a、b,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。相同时间、不同温度下测得使用催化剂a时脱氮率与温度的关系如图4中曲线Ⅰ所示。已知催化效率b>a,催化剂b的活性在450℃时最大(未达平衡)。请在图4中画出使用催化剂b时所对应的曲线(从300℃开始画)。_______________
N2(g)+2CO2(g)。相同时间、不同温度下测得使用催化剂a时脱氮率与温度的关系如图4中曲线Ⅰ所示。已知催化效率b>a,催化剂b的活性在450℃时最大(未达平衡)。请在图4中画出使用催化剂b时所对应的曲线(从300℃开始画)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸碱中和滴定是中学化学定量分析的一种重要方法。已知在25℃时,取20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,用浓度为0.1000mol/L的NaOH溶液分别进行滴定,滴定曲线如图所示。下列说法不正确的是( )。

A.在相同温度下,同浓度的三种酸溶液的pH大小顺序为:HZ<HY<HX
B.当V(NaOH)=10mL时,在HY溶液中由水电离出的![]()
C.HY与HZ混合,达到平衡时:![]()
D.根据上述滴定曲线,可计算得Ka(HY)≈10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )

A. X原子可能为第ⅤA族元素
B. Y原子一定为第ⅠA族元素
C. 该分子中既含有极性共价键又含有非极性共价键
D. 从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究链状有机物X(H2C2O4)的结构及性质:
结构
已知:双键碳上连羟基不稳定。
(1)推测X可能的结构___________ 、____________(填结构简式)(X分子中无-O-O-结构)。
核磁共振氢谱显示X分子中只有一种氢原子,可以确定X分子为乙二酸。
性质探究:
查资料可知:乙二酸(HOOC-COOH)俗称草酸,易溶于水,属于二元中强酸,酸性强于碳酸,其熔点为101.5℃,在157℃升华。
类别角度:
(2)用化学方程式表征乙二酸类别通性中的两种性质:_________ 。
(3)在通性研究过程中,同学们发现:等物质的量的草酸和NaOH混合,溶液呈酸性,其原因可能与_____机理最接近。
a HCl溶液显酸性 b 苯酚溶液显酸性 c NaHSO3溶液显酸性
化合价角度:
(4)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMO4溶液,振荡,发现溶液的紫红色褪去,说明乙二酸具有___________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____MnO4-+ ____H2C2O4+ ____H+=____ Mn2++____CO2↑+____H2O。
特性角度:
(5)同学网上查阅乙二酸性质,发现了以下实验:(夹持装置未标出)
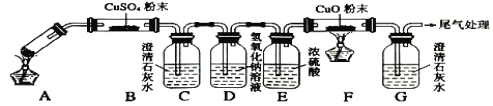
A中盛放少量草酸晶体,实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,据此回答:上述装置中,D的作用是__________。写出上述实验中草酸发生反应的方程式_______。
(6)小结草酸的化学性质___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.一定温度下,反应MgCl2(l)=Mg(1)+Cl2(g)的 △H>0 △S>0
B.用N2(g)+3H2(g)=2NH3(g)△H<0设计的燃料电池,N2(g)在正极上进行反应
C.氯化镁溶液加热蒸干得不到纯净氯化镁固体
D.常温下,向饱和![]() 溶液中加少量
溶液中加少量![]() 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下
粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物![]() ,2元素可形成负一价离子。下列说法正确的是( )
,2元素可形成负一价离子。下列说法正确的是( )
A.X元素基态原子的电子排布式为![]()
B.X元素是第4周期第VA族元素
C.Y元素原子的轨道表示式为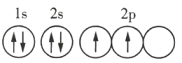
D.Z元素的单质Z2在氧气中不能燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com