
下列有关实验的叙述不正确的是( )
A.向硫代硫酸钠溶液中滴加稀硫酸会产生淡黄色沉淀和刺激性气味气体
B.向5mL 0.1mol/L的K2Cr2O7溶液中滴加10滴6mol/L的NaOH溶液后溶液的橙色加深
C.测定中和热时,若用50mL 0.55mo1•L﹣1的氢氧化钠溶液,分别与50mL0.50mo1•L﹣1的盐酸和50mL 0.50mo1•L﹣1的硫酸充分反应,两次实验测定的中和热是相等的
D.KMnO4溶液与草酸溶液反应时褪色速度先慢后快
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:选择题
有M、N两溶液,各含有下列十四种离子中的七种离子:Al3+、Na+、K+、Fe3+、NH4+、H+、NO3-、OH-、MnO4-、Cl-、SO32-、SO42-、CO32-、AlO2-。已知两溶液所含离子各不相同,每组溶液中的阳离子至少有2种,则下列说法正确的是
A.如果M溶液呈强酸性,则N溶液中可能含有的阴离子有:OH-、NO3-、CO32-
B.如果M溶液呈强碱性,则N溶液中可能含有的阴离子有:MnO4-、AlO2-、SO42-
C.如果M溶液具有强还原性,则N溶液中可能含有的阴离子有:MnO4-、NO3-、SO42-
D.如果M溶液具有强氧化性,则N溶液中可能含有的阳离子有:K+、Na+、 NH4+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下期末化学试卷(解析版) 题型:填空题
海水资源的利用具有广阔前景。海水中主要离子的含量如下表所示。
成分 | 含量(mg·L-1) | 成分 | 含量(mg·L-1) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 | HCO3- | 142 |
SO42- | 2560 | Br- | 64 |
Mg2+ | 1272 |
利用海水可以提取溴和镁,提取过程如下。

(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①__ ___,
吸收塔中发生反应的离子方程式是:②_____________ _______。
用平衡移动原理解释通空气的目的:③___ ____________。
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O―→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是①____ ____、过滤、洗涤、干燥。最后一步冶炼得到金属镁的化学方程式为②____ ____;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③____ __________。
(4)依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2
的体积为________L(忽略Cl2的溶解)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下期末化学试卷(解析版) 题型:选择题
海藻中含有丰富的以离子形式存在的碘元素。下图是实验室从海藻中提取碘的流程的一部分。

下列判断正确的是( )
A.步骤①、③的操作分别是过滤、萃取
B.可用硝酸银溶液检验步骤②的反应是否进行完全
C.步骤③中加入的有机溶剂是裂化汽油或四氯化碳
D.步骤④的操作是过滤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g),则下列说法正确的是( )
CH3OCH3(g)+H2O(g),则下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正反应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,
则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
已知298 K时,2SO2(g)+O2(g) 2SO3(g) ΔH=–197 kJ/mol,下列说法正确的是( )
2SO3(g) ΔH=–197 kJ/mol,下列说法正确的是( )
A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大
B.向某恒容密闭容器中通入1mol SO2和0.5 molO2,达到平衡时放出热量为98.5 kJ
C.升高温度能使逆反应速率加快,正反应速率减慢
D.向某恒容密闭容器中通入一定量的SO2和O2达到平衡后,再通入少量气体He,
平衡不移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
对于反应CO(g)+2H2(g) CH3OH(g)ΔH,反应过程中的能量变化情况如下图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)ΔH,反应过程中的能量变化情况如下图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
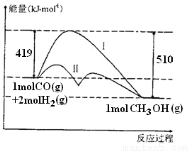
A.该反应的ΔH=+91kJ/mol
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH时为ΔH1,则ΔH1 >ΔH
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二下学期期末化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. 物质的沸点: 正戊烷 > 异戊烷 > 新戊烷
B. 相同条件下与钠反应的剧烈程度: >
> > CH3OH
> CH3OH
C. 常温常压下各物质的密度: >
> > H2O > CH3COOCH2CH3
> H2O > CH3COOCH2CH3
D. 常温下物质在水中的溶解性:CH3CH2OH > > CH3CH3
> CH3CH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二下学期期末化学试卷(解析版) 题型:选择题
某可逆反应为2X(g) 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
下列推断正确的是( )。
A.在该条件下M点X平衡转化率为
B.压强大小有P3>P2>P1
C.平衡后加入高效催化剂使气体相对分子质量增大
D.升高温度,该反应平衡常数K减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com