
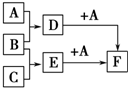
 已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.
已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.分析 A与B反应生成D,D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,则D是氯化铁,A、B都是单质,且A是固体,所以A是铁,B是氯气;B和C反应生成E,E极易溶于水得无色溶液E,则C是氢气,E是氯化氢,盐酸和铁反应生成氯化亚铁与氢气,符合转化关系,则F是氯化亚铁,以此解答该题.
解答 解:A与B反应生成D,D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,则D是氯化铁,A、B都是单质,且A是固体,所以A是铁,B是氯气;B和C反应生成E,E极易溶于水得无色溶液E,则C是氢气,E是氯化氢,盐酸和铁反应生成氯化亚铁与氢气,符合转化关系,则F是氯化亚铁,
(1)依据上述分析可知,A:Fe B:Cl2 C:H2 F:FeCl2.
故答案为:Fe;Cl2;H2;FeCl2;
(2)F为FeCl2,加入氢氧化钠生成Fe(OH)2白色沉淀,反应的化学方程式为FeCl2+2NaOH═Fe(OH)2↓+2NaCl,Fe(OH)2不稳定,易被空气中的氧气氧化生成Fe(OH)3,方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:FeCl2+2NaOH═Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评 本题考查物质的推断,为高频考点,侧重于学生的分析能力的考查,“D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色”是突破口,明确物质的性质及特殊性是解本题关键,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,2.8gCO与N2混合气体中含有的原子总数为0.2NA | |
| B. | 标准状况下,2.24L乙烷含有分子的数目为0.1NA | |
| C. | 1L1mol•L-1的CuCl2溶液中含有Cu2+的数目为NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
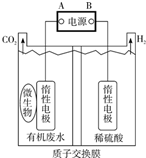 在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )
在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )| A. | 电极A为负极 | |
| B. | 电解中生成的CO2与H2物质的量之比为1:1 | |
| C. | 阳极反应为:CH3COOH一8e-+8OH-═2CO2↑+6H2O | |
| D. | 电解前后,阴极室的pH几乎保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

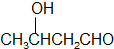 $→_{②}^{△}$CH3CH=CHCHO
$→_{②}^{△}$CH3CH=CHCHO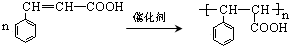 .
.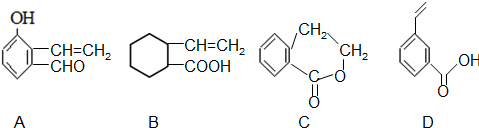
 →E 的合成路线(试剂及溶剂任选:合成路线参照“已知①”中书写形式)
→E 的合成路线(试剂及溶剂任选:合成路线参照“已知①”中书写形式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置实现化学能向电能的转化 | |
| B. | 该电池的总反应为2NO+O2═2NO2 | |
| C. | 当有2.24L的O2参与反应时,转移了0.4mole- | |
| D. | NiO电极的电极反应式:NO+O2--2e-═NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
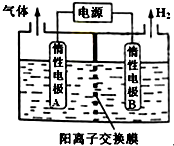 利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )
利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )| A. | B极区电解质溶液为LiOH溶液 | |
| B. | 阳极电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 电解过程中主要是H+通过阳离子交换膜向B电极迁移 | |
| D. | 电极A连接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯、裂化汽油、溴苯、福尔马林 | |
| B. | 乙醇、乙酸、乙醛、乙苯 | |
| C. | 苯甲酸溶液、甘油、甲苯、甲酸 | |
| D. | 苯酚、苯乙烯、苯、1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | Y>Z>X | D. | Z>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com