
 按如图装置进行实验,并回答下列问题:
按如图装置进行实验,并回答下列问题:| 0.224L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、只有②③ | B、只有①④ |
| C、只有①③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水能导电,所以氯气是电解质 |
| B、碳酸钙不溶于水,所以它是非电解质 |
| C、固体磷酸是电解质,所以磷酸在熔化状态下和溶于水时都能导电 |
| D、胆矾虽不能导电,但它属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
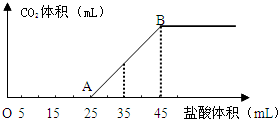 将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况下测定)关系如图所示:
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况下测定)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Z>R>W |
| B、X2W6分子中各原子均满足8电子结构 |
| C、气态氢化物的稳定性:HmW>HnR |
| D、Y、Z形成的化合物中只可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述实验中,共有两个氧化还原反应 |
| B、上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 |
| C、实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D、实验②证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
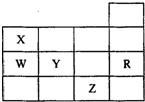 如图为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是( )| A、常温常压下,五种元素的单质中有两种是气态 |
| B、Y、Z的阴离子电子层结构都与R原子的相同 |
| C、W的氢化物比X的氢化物稳定 |
| D、Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com