
| m |
| M |
| 27 |
| NA |
| 27 |
| NA |
| 4g |
| 2g/mol |
| 33.6L |
| 22.4L/mol |
| 3.01��1023 |
| 6.02��1023 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2�� | B��3�� | C��4�� | D��5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ϩ�Ľṹ��ʽ��CH2CH2 |
B����ϩ�ļ���ʽ�� |
| C��һ�������£�ij�ܱ������г���2molSO2��g����1molO2��g�����ﵽƽ��ų�QkJ�����������Ȼ�ѧ����ʽΪ��2SO2��g��+O2��g���T2SO3��g ����H=-QkJ?mol-1 |
| D������ı�ȼ���ȡ�H=-890.3 kJ?mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
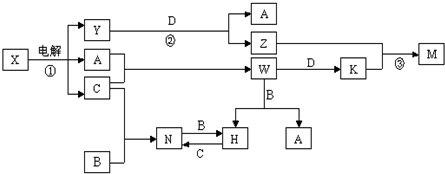
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1������7�����ʣ�
��1������7�����ʣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1mol ���к���̼̼˫������ĿΪ3NA |
| B��28g��ϩ�������õ��Ӷ���ĿΪ2NA |
| C��1mol-CH3�������к��е�����Ϊ8NA |
| D��������ϩ����ϩ����ϩ�Ļ�����干14g����ԭ����Ϊ3NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com