
下列离子方程式中,不正确的是
A.向FeCl2溶液中通入 Cl2 2Fe2+ + Cl2 = 2Fe3+ + 2Clˉ
B.FeCl3溶液跟过量氨水 Fe3+ + 3NH3?H2O = Fe(OH)3↓ + 3NH4+
C.碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑
D.钠与水的反应 2Na + 2H2O = 2Na+ + 2OH- + H2↑
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:填空题
(16分)已知合成氨的反应为3H2(g)+N2(g) 2NH3(g) △H<0,在某密闭容器中测得实验数据及数据处理如下表。
2NH3(g) △H<0,在某密闭容器中测得实验数据及数据处理如下表。
(1)下列说法可以说明合成氨反应达到平衡的是
A.恒容时,整个容器内密度不变
B.恒压时,容器内平均相对分子质量不变
C.1 mol N≡N键断裂的同时,有3mol H-H键断裂
(2)当升高温度时,平衡向 方向移动(填“正”或“逆”),请画出在t2时刻升温后的v-t图,并作出必要的标注。

(3)表中实验2的K2= ,温度T1、T2的大小关系是 ,你判断的理由是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2能使溴水褪色 |
B | 铁比铜活泼 | 铜容器可以盛放浓硝酸 |
C | 铜绿的主成分是碱式碳酸铜 | 可用稀盐酸除去铜器表面的铜绿 |
D | 铜表面易形成致密的氧化膜 | 铜板上的铁钉在潮湿空气中不易生锈 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
物 质 | CH4 | CO2 | CO | H2 |
平衡浓度(mol·L-1) | 0.5 | 0.5 | 2.0 | 2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4  CH3COOH, 请回答:
CH3COOH, 请回答:
① 温度与催化剂的催化效率和乙酸的生成速率如图。

250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。
② 为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
③ Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
② Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:填空题
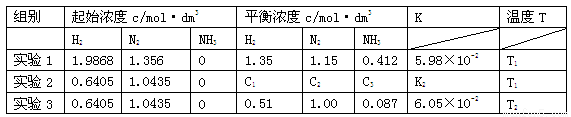
(17分)实验室常用的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氨气,如果用B装置,通常使用的药品是________;如果用C装置,通常使用的药品是________;
检查B装置气密性的操作方法是_____________________________________________。
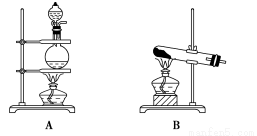
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________
①CO2 ②NO ③Cl2 ④H2
写出A装置中反应的离子方程式____________________________________
其中在D装置中连接小烧杯中应盛放________,目的是_________________________________。
若要收集干燥纯净的X气体,上述装置应如何改进________________________________
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 稀盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:实验题
(16分)白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业生产钨流程如下:

(完全沉淀离子的pH值:SiO32-为8,WO42-为5)
(1)白钨矿反应前需要进行粉碎,其目的是____________。CaWO4与纯碱发生的化学反应方程式是_______________________________。
(2)滤渣A的主要成分是(写化学式)_____________,滤渣B的化学式是__________。
(3)调节pH可选用的试剂是:__________。
A.氨水 B.氢氧化钠溶液 C.盐酸
(4)母液中加入盐酸的离子方程式为________________________________________。
(5)白钨矿中CaWO4的质量分数为30%,576千克白钨矿理论上最多能生产钨_____kg。(已知钨酸钙的相对分子质量为288)
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
下列离子在指定条件下能大量共存的是
A.在酸性溶液中:Ba2+、K+、SO32―、Cl―
B.含有大量Al3+的溶液中:K+、Na+、NH4+、SO42―
C.使甲基橙变黄的溶液中:Na+、I―、CO32―、OH―
D.无色溶液中:K+、Cl―、Cr2O72-、HCO3―
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com