
【题目】下列混合物的分离方法不正确的是( )
A.泥沙和食盐(溶解,过滤)
B.汽油和水(分液)
C.KNO3和KCl(降温结晶)
D.酒精和水(分液)
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是一种二元弱酸,向某依度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3-、HPO32-的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
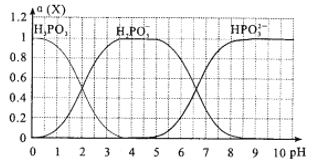
(1)以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_____________
(2)H3PO3的第一步电离H3PO3![]() H2PO3-+H+的电离平衡常数为Ka1,则pKa1=_______ (pKa1=-lgKa1)。
H2PO3-+H+的电离平衡常数为Ka1,则pKa1=_______ (pKa1=-lgKa1)。
(3)将0.lmol/L的NaOH逐滴滴入0.1mo/L的亚磷酸,为了主要得到Na2HPO3,反应应控制pH至少为_______;当反应至溶液呈中性时,c(Na+)______c(H2PO3-)+ 2c(HPO32-)(填“>”、“<”或“一”)。
(4)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法不正确的是
A. 23gCH3CH2OH与30gCH3COOH反应,生成CH3COOCH2CH3的分子数为0.5NA
B. 15.6g由Na2S和Na2O2组成的混合物中,含有的阴离子数目为0.2NA
C. 32.5g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D. 过量MnO2与浓盐酸反应产生1molCl2,转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于![]() 的分子结构,下列说法正确的是( )
的分子结构,下列说法正确的是( )
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 除苯环外的其余碳原子不可能都在一条直线上
C. 12个碳原子不可能都在同一平面上
D. 所有原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钚(23994Pu)是制造威力更大原子弹的良好原料。下列有关说法错误的是
A. 原子序数为94 B. 电子数为94 C. 中子数为94 D. 质量数为239
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置。
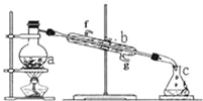
(1)写出下列仪器的名称:a.__b.__。
(2)实验过程中,需要通冷水,图中的进水方向是__进(填图中字母)。
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的用品是__。
(4)若用装置制蒸馏水,实验时a中除加入少量自来水外,还需加入少量__,其作用是防止暴沸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料料中含有Cr(OH)3、Al2O3、CuO、NiO等物质,工业上通过下列流程回收其中有用的金属和制取Na2Cr2O7。
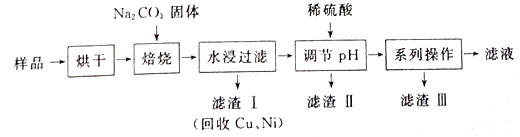
已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物质
②除去滤渣II后,溶液中存在反应2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
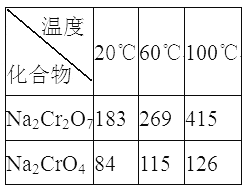
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:
(1)“焙烧”过程中生成NaAlO2化学方程式为_____________________。
(2)生成滤渣II时,需加入适量稀硫酸调节溶液的pH除去A1O2-。若稀硫酸过量,则因过量引起反应的离子方程式为______________________。
(3)“系列操作”为:继续加入稀硫酸、_____、冷却结晶、过滤。继续加入稀硫酸的目的是_____________,滤渣III的主要成分是_________(填化学式)。
(4)工业上还可以在“水浸过滤’’后的溶液中加人适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为______________。
(5)流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20mL,水稀释至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol L-1的FeSO4溶液进行氧化还原滴定,到终点时消耗FeSO4溶液体积为V mL[已知发生的反应为Na2Cr2O7 + FeSO4 + H2 SO4![]() Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应aX(g)+bY(g)=cZ(g)的各物质浓度数据如下:
X | Y | Z | |
起始浓度(molL-1) | 0.3 | 0.5 | 0 |
5s末浓度(molL-1) | 0.1 | 0.4 | 0.3 |
据此可推算出上述化学方程式中X、Y、Z三种物质的化学计量数之比是( )
A.2:1:3
B.3:1:2
C.1:4:3
D.3:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com