
| 实验目的 | 实验操作 |
| A.证明Fe3+与SO2发生了氧化还原反应 | 将过量SO2通入FeCl3溶液中,然后将反应液加入酸性高锰酸钾溶液中,发现高锰酸钾溶液褪色 |
| B.除去CH3COOC2H5中的乙醇 | 加入适量CH3COOH,加热 |
| C.比较AgCl和AgI的 Ksp大小 | 向10mL浓度均为0.01mol/L的NaCl和KI混合溶液滴加少量0.01mol/L AgNO3溶液,观察现象 |
| D.比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH值,比较pH大小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Fe2+、SO2都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
B.乙醇和乙酸在没有催化剂条件下不反应,乙醇易溶于水、乙酸乙酯不易溶于水;
C.溶度积表达式相同时,溶度积常数小的物质先产生沉淀;
D.酸的酸性越强,其对应的钠盐溶液pH越小.
解答 解:A.Fe2+、SO2都能和酸性高锰酸钾溶液发生氧化还原反应而使酸性高锰酸钾溶液褪色,所以不能用酸性高锰酸钾溶液检验,应该用铁氰化钾溶液检验,故A错误;
B.二者互溶,乙醇能溶于水、乙酸乙酯不溶于水,所以可以用水作萃取剂,然后采用分液的方法分离,故B错误;
C.AgCl和AgI的溶度积常数表达式相同,溶度积小的先产生沉淀,向10mL浓度均为0.01mol/L的NaCl和KI混合溶液滴加少量0.01mol/L AgNO3溶液,根据沉淀颜色判断溶度积大小,故C正确;
D.CO32-对应的酸是HCO3-而不是H2CO3,所以不能根据碳酸钠溶液和NaCN溶液pH大小判断酸性强弱,应该用相同浓度的NaCN、NaHCO3溶液比较,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、除杂、溶度积大小比较、酸性强弱比较等知识点,明确实验原理、物质性质差异性是解本题关键,侧重考查学生实验操作、实验分析及评价能力,易错选项是D.


科目:高中化学 来源: 题型:实验题
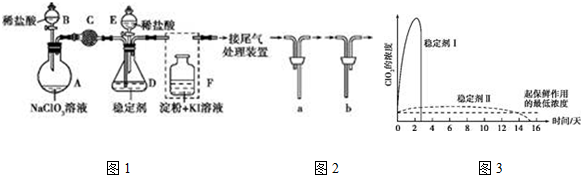
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
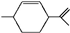 .有关萜二烯的说法不正确的是( )
.有关萜二烯的说法不正确的是( )| A. | 萜二烯的分子式为C10H16,不属于芳香烃 | |
| B. | 可溶于乙醇或乙醚,不溶于水 | |
| C. | 萜二烯分子中所有碳原子处于同一个平面上 | |
| D. | 萜二烯与过量的溴的四氯化碳溶液反应后的产物为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将盐卤或石膏加入豆浆,制成美味可口的豆腐 | |
| B. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀,即可制得Fe(OH)3胶体 | |
| C. | 放电影时,放映室射到屏幕上的光柱 | |
| D. | 在盛有红褐色Fe(OH)3胶体的U形管两端加上直流电压后,阴极附近颜色逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HBr、HCl、BaSO4 | B. | NH4Cl、CH3COONa、Na2S | ||
| C. | NaOH、Ca(OH)2、NH3•H2O | D. | HClO、NaF、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 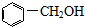 醇类-OH 醇类-OH | |
| B. | CH3CH2CH2COOH 羧酸-COOH | |
| C. | 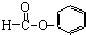 醛类-CHO 醛类-CHO | |
| D. | CH3-O-CH3 醚类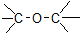 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
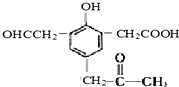 ,试回答:
,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com