
| ||
| ||


科目:高中化学 来源: 题型:
| A、阴极生成的铜为5.6g |
| B、上述电解过程中共转移0.2 mol电子 |
| C、电解得到的Cu的物质的量为0.5mol |
| D、电解后溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,蓄电池由化学能转化为电能 |
| B、充放电时,溶液的导电能力变化不大 |
| C、放电时的负极反应式为:Pb-2e-=Pb2+ |
| D、充电时的阳极反应式为:Pb2++4OH-+2e-=PbO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCN |
| H2O |
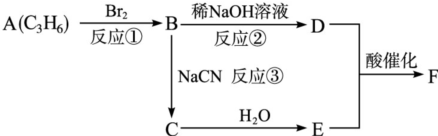
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑤⑦ | B、④⑤⑦ |
| C、④⑤ | D、③④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,Kw增加,pH增大 |
| B、向水中加入少量NaOH固体,平衡向逆方向移动,c(OH-)增大 |
| C、向水中加入少量CH3COONa固体,平衡向正方向移动,c(H+)增大 |
| D、25℃时,纯水中c(H+)>10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,则H2SO4和Ba(OH)2反应的反应热△H=-114.6kJ?mol-1 | ||
B、燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+
| ||
| C、若常温时H2(g)的燃烧热是285.8 kJ?mol-1,则2H2O(g)=2H2(g)+O2(g)△H=+571.6kJ?mol-1 | ||
| D、常温时葡萄糖的燃烧热是2800 kJ?mol-1,则1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O( l )△H=-1400 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有Fe2+ |
| B、有Fe2+和Fe3+ |
| C、有Cu2+和Fe2+ |
| D、有H+和Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com