
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500 s内NO2的生成速率为2.96×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时NO2的产率为25%
C. 达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
【答案】D
【解析】
A、依据图标数据分析计算500s内N2O5(g)消耗的浓度计算分解率;
B、由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,计算平衡浓度,根据转化率=消耗量/起始量×100%计算;
C、其他条件不变时,将容器的体积压缩到原来的1/2,若平衡不移动,此时N2O5(g)浓度为5.00molL-1;
D.平衡常数只受温度影响,正反应为吸热反应,升高温度平衡正向移动。
A项、依据图标数据分析计算500s内N2O5(g)消耗的浓度=5.00mol/L-3.52mol/L
=1.48mol/L,分解速率=![]() =2.96×10-3mol/(Ls),故A错误;
=2.96×10-3mol/(Ls),故A错误;
B项、由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,c(NO2)=5mol/L,c(O2)=1.25mol/L,转化率为(5mol/L2.5mol/L)/5mol/L×100%=50%,故B错误;
C项、其他条件不变时,将容器的体积压缩到原来的1/2,若平衡不移动,此时N2O5(g)浓度为5.00molL-1,但增大压强,平衡逆向移动,则平衡时c(N2O5)>5.00molL-1,故C错误;
D项、正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,若T1>T2,则K1>K2,故D正确。
故选D。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.离子化合物中一定含离子键
B.离子化合物不可能只由非金属元素组成
C.离子化合物均能溶于水
D.熔化状态下能导电的物质一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一,早在远古时代,人们便发现并使用了锡。回答下列问题:
(1)锡是50号元素,在元素周期表中位于________区。
(2)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子的空间构型为________。
(3)比较下列卤化锡的熔点和沸点,分析其变化规律及原因____________________________________
SnCl4 | SnBr4 | SnI4 | |
熔点/℃ | -33 | 31 | 144.5 |
沸点/℃ | 114.1 | 202 | 364 |
(4)汽车废气中常含有有毒的一氧化碳气体,但在二氧化锡的催化下,在300 ℃时,一氧化碳可大部分转化为二氧化碳。C、O、Sn电负性由大至小的顺序是__________________________________________。
(5)灰锡具有金刚石型结构,其中Sn原子的杂化方式为________,微粒之间存在的作用力是__________________________________。
(6)①原子坐标参数,表示晶胞内部各原子的相对位置,如图为灰锡的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0/1/2),则D为(1/4,___ ,___ )。锡的配位数为________。
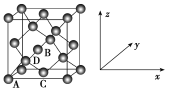
②已知灰锡的晶胞参数a=0.648 9 nm,其密度为______ g·cm-3(NA为6.02×1023 mol-1,不必算出结果,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是甲、乙、丙三种固体物质的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )

A. 甲物质的溶解度比乙物质的溶解度大
B. 加入试管1的固体是丙
C. 向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出
D. 将30℃时甲、乙、丙三种物质的饱和溶液各100g降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明苯分子结构中不存在单双键交替的事实是( )。
A.苯的二元取代物无同分异构体B.苯的邻位二元取代物只有一种
C.苯的间位二元取代物只有一种D.苯的对位二元取代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为______,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的____可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn在现代工业中对于电池制造上有不可磨灭的地位,明朝末年宋应星所著的《天工开物》一书中就有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)Zn基态原子的电子排布式为___________,4s能级上的成对电子数为___________。
(2)葡萄糖酸锌{[CH2OH( CHOH)4COO]2Zn}是目前市场上流行的补锌剂。葡萄糖酸锌中碳原子杂化形式有___________,C、H两元素的第一电离能的大小关系为___________________。
(3)ZnCl2与NH3形成的配合物[Zn(NH3)4]Cl2中,存在___________(填字母)。
A离子键 B.σ键 C.π键
(4)锌与某非金属元素X形成的化合物晶胞如图所示,其中Zn和X通过共价键结合,该化合物中Zn与X的原子个数之比为___________。
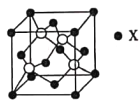
(5)在图示晶胞中若只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___________堆积;设阿伏加德罗常数的数值为NA,该晶胞中Zn的半径为r1nm,X的半径为r2nm,X的相对原子质量为M,则该晶体的密度为___________g·cm-3(用含r1、r2、M、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com