
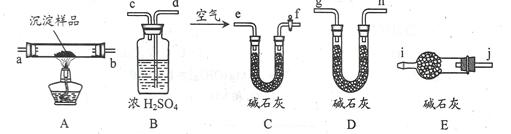
| 实验步骤 | 预期现象 | 结论 |
| ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→___→___→___→___→j→i顺序连接。 | | |
| ②称取一定质量的沉淀______________________,然后___________________,冷却后再称量B、D的质量分别为m3、 m4 | (1)若m1 = m3,m2 < m4 (2)若m1___m3,m2___m4 (3)若ml___m3,m2___m4 | (1)假设1成立 (2)假设2成立 (3)假设3成立 |
| 实验步骤 | 预期现象 | 结论 |
| ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→d→c→g→h或d→c→h→g(2分)→j→i顺序连接。 | | |
| ②称取一定质量的沉淀于A中充分加热,然后从e口通入足量空气(2分),冷却后再称量B、D的质量分别为m3、m4 | (1)若m1 = m3,m2 < m4 (2)若m1_<__m3,m2_=__m4 (3)若ml_<__m3,m2_<__m4(4分) | (1)假设1成立 (2)假设2成立 (3)假设3成立 |
 ×100%(或
×100%(或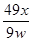 ×100%、49x/9w、4900x/9w%)(2分)
×100%、49x/9w、4900x/9w%)(2分) CuO+H2O↑中各物质的系数之比等于物质的量之比,则参加反应的氢氧化铜的物质的量为x/18mol;由于Cu(OH)2的式量为98,m=n?M,则参加反应的氢氧化铜的质量为98x/18g;由于沉淀样品质量为wg,则沉淀中氢氧化铜的质量分数为
CuO+H2O↑中各物质的系数之比等于物质的量之比,则参加反应的氢氧化铜的物质的量为x/18mol;由于Cu(OH)2的式量为98,m=n?M,则参加反应的氢氧化铜的质量为98x/18g;由于沉淀样品质量为wg,则沉淀中氢氧化铜的质量分数为 ×100%=
×100%=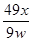 ×100%。
×100%。

 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的ΔH<0 |
| D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀 变为黄色 | 溶度积:AgI比 AgCl更小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
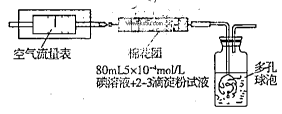
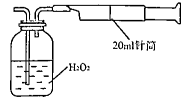 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
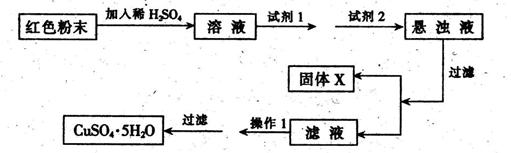
 ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。| 物 质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 操 作 步 骤 | 实验现象 | 结 论 |
| 步骤I:取少量待检液于试管中, 。 | | 溶液中含有Fe2+ |
| 步骤II:取少量待检液于试管中, 。 | | 溶液中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 |
| B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C.用CCl4萃取碘水中的I2时,有机层从分液漏斗的上端倒出 |
| D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图1探究NaHCO3的热稳定性 |
| B.图2证明铁生锈与空气有关 |
| C.图3定量测定H2O2的分解速率 |
| D.图4证明CH3CH2OH发生消去反应生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.因为Ksp(CaCO3)<Ksp(CaSO4),所以可用Na2CO3和HCl除去水垢中的CaSO4 |
| B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| C.滴有酚酞的碳酸氢钠溶液呈浅红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠 |
D.硫化钠溶于水中发生反应的离子方程式为S2 –+ 2H2O H2S + 2OH – H2S + 2OH – |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com