
 A、B、C、D均为含硅的化合物,其中B的水溶液俗称水玻璃,其相互转化关系如图所示.
A、B、C、D均为含硅的化合物,其中B的水溶液俗称水玻璃,其相互转化关系如图所示.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
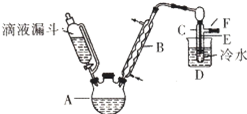 滴液漏斗已知:R-OH+HX→R-X+H2O
滴液漏斗已知:R-OH+HX→R-X+H2O| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g?cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如的甲、乙、丙三种物质均含有相同的某种元素,箭头表示甲、乙丙物质问的转化一步就能实现,则甲可能是( )
如的甲、乙、丙三种物质均含有相同的某种元素,箭头表示甲、乙丙物质问的转化一步就能实现,则甲可能是( )| A、①③⑤ | B、①②③ |
| C、①②③⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可能为升温 |
| B、平衡一定不移动 |
| C、H2 转化率增大 |
| D、HI平衡浓度一定变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com