
取
Na2CO3和NaHCO3的混合物9.5 g加水配成稀溶液,然后向该溶液中加入9.6 g碱石灰,充分反应后Ca2+、HCO3-、CO32-恰好转化为沉淀.将反应器内的水蒸干,可以得到20 g白色固体.求原混合物中Na2CO3和NaHCO3的质量.科目:高中化学 来源: 题型:阅读理解
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 试剂1 | 试剂2温度(℃) | 溶解后温度(℃) |
| 0.5g NaHCO3固体 | 10mL水 19.0 | 18.4 |
| 0.5 g Na2CO3固体 | 10mL水 19.0 | 25.5 |
| 试剂1/温度(℃) | 试剂2/温度(℃) | 恰好反应后温度(℃) |
| 含0.5g NaHCO3固体的饱和溶液/19.0 | 6mL稀盐酸/19.0 | 18.3 |
| 含0.5 g Na2CO3固体的饱和溶液/19.0 | 9mL稀盐酸/19.0 | 22.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4
(1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市重庆一中高一10月月考化学试卷(带解析) 题型:实验题
(14分)I.实验室用Na2CO3·10H2O晶体配制50 g质量分数为21.2%的Na2CO3溶液。回答下列问题:
(1)应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时犯了一个错误是 。实际称量的碳酸钠晶体质量为 g。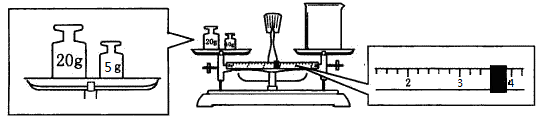
II. 实验室要配制2.5 mol/L 的稀硫酸溶液90 mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84 g/cm3的浓硫酸 mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是 。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 。
| A.量取浓硫酸时,仰视读数 |
| B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中 |
| C.稀释硫酸时,有溶液溅到桌面上 |
| D.没有洗涤稀释硫酸的烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高一10月月考化学试卷(解析版) 题型:实验题
(14分)I.实验室用Na2CO3·10H2O晶体配制50 g 质量分数为21.2%的Na2CO3溶液。回答下列问题:
(1)应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时犯了一个错误是 。实际称量的碳酸钠晶体质量为 g。
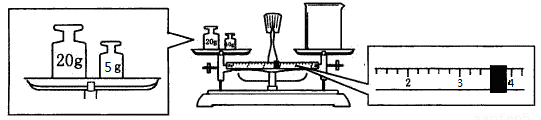
II. 实验室要配制2.5 mol/L 的稀硫酸溶液90 mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84 g/cm3的浓硫酸 mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是 。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 。
A.量取浓硫酸时,仰视读数
B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
C.稀释硫酸时,有溶液溅到桌面上
D.没有洗涤稀释硫酸的烧杯和玻璃棒
E.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
F.容量瓶不干燥
(4)从容量瓶中取该溶液40 mL,与5 mol/L的NaOH溶液 mL恰好完全反应,反应后溶液中的c(Na+)= (忽略溶液混合过程中的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
A.加热蒸馏
B.加入Na2CO3后,通过萃取的方法分离
C.先加入烧碱溶液,之后蒸出乙醛,再加入浓H2SO4,蒸出乙酸
D.和Na反应后进行分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com