
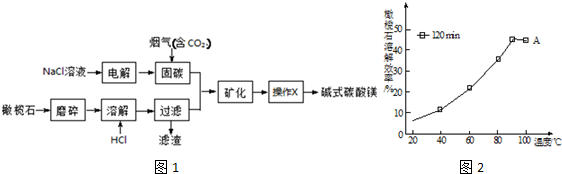
分析 橄榄石磨碎后溶解,然后加入HCl,发生的反应为Mg2SiO4+4HCl═2MgCl2+SiO2+2H2O,过滤,得到滤液;氯化钠溶液电解生成氯气、氢气和NaOH,通入烟气后能固碳,应该是NaOH和二氧化碳反应生成碳酸钠或碳酸氢钠,碳酸钠和氯化镁或碳酸氢钠和氯化镁反应生成碱式碳酸镁,然后过滤得到碱式碳酸镁,
(1)某橄榄石的组成是(MgFe)2(SiO4)2,用氧化物的形式表示时,先写活泼金属氧化物、后写较不活泼金属氧化物,最后写二氧化硅;
(2)固碳(足量的CO2)时氢氧根离子和二氧化碳反应生成碳酸氢根离子;
能和烟气反应生成可溶性碳酸盐的物质能固碳;
(3)矿化的反应为镁离子和碳酸氢根离子或碳酸根离子的反应;分离难溶性固体和溶液采用过滤方法;
(4)反应物接触面积越大,反应速率越快;该反应是放热反应,温度越高其转化率越小;
(5)每小时烟气中n(CO2)=$\frac{22.4{m}^{3}/min×60min×10%×1000L/{m}^{3}}{22.4L/mol}$=6000mol,再根据二氧化碳和碱式碳酸镁之间的关系式计算.
解答 解:橄榄石磨碎后溶解,然后加入HCl,发生的反应为Mg2SiO4+4HCl═2MgCl2+SiO2+2H2O,过滤,得到滤液;氯化钠溶液电解生成氯气、氢气和NaOH,通入烟气后能固碳,应该是NaOH和二氧化碳反应生成碳酸钠或碳酸氢钠,碳酸钠和氯化镁或碳酸氢钠和氯化镁反应生成碱式碳酸镁,然后过滤得到碱式碳酸镁,
(1)某橄榄石的组成是(MgFe)2(SiO4)2,用氧化物的形式表示时,先写活泼金属氧化物、后写较不活泼金属氧化物,最后写二氧化硅,所以其氧化物的形式为MgO•FeO•SiO2,故答案为:MgO•FeO•SiO2;
(2)固碳(足量的CO2)时氢氧根离子和二氧化碳反应生成碳酸氢根离子,离子方程式为OH-+CO2=HCO3-;
能和烟气反应生成可溶性碳酸盐的物质能固碳,符合条件的只有ad,
故答案为:OH-+CO2=HCO3-;ad;
(3)矿化的反应为镁离子和碳酸氢根离子或碳酸根离子的反应,离子方程式为2Mg 2++4HCO3-=Mg2(OH)2CO3↓+H2O+3CO2↑或2Mg 2++2CO32-+H2O=Mg2(OH)2CO3↓+CO2↑;分离难溶性固体和溶液采用过滤方法,所以该操作方法是过滤,
故答案为:2Mg 2++4HCO3-=Mg2(OH)2CO3↓+H2O+3CO2↑或2Mg 2++2CO32-+H2O=Mg2(OH)2CO3↓+CO2↑;过滤;
(4)反应物接触面积越大,反应速率越快,粉碎的目的是增大反应物接触面积,加快反应速率;该反应是放热反应,温度越高其转化率越小,所以90℃、120min时,溶解达到平衡,而反应放热,升温平衡逆向移动,故溶解效率降低,
故答案为:增大接触面积,加快溶解速率;90℃、120min时,溶解达到平衡,而反应放热,升温平衡逆向移动,故溶解效率降低;
(5)每小时烟气中n(CO2)=$\frac{22.4{m}^{3}/min×60min×10%×1000L/{m}^{3}}{22.4L/mol}$=6000mol,
根据C原子守恒得n(CO2)=n[Mg2(OH)2CO3]=6000mol,则得到的碱式碳酸镁的质量=6000mol×142g/mol=852000g=852kg,故答案为:852.
点评 本题考查物质制备,为高频考点,侧重考查学生分析、判断、计算及知识综合运用能力,涉及化学方程式的计算、反应速率影响因素、物质分离和提纯、离子方程式的书写等知识点,明确基本原理、元素化合物性质、物质分离和提纯方法是解本题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
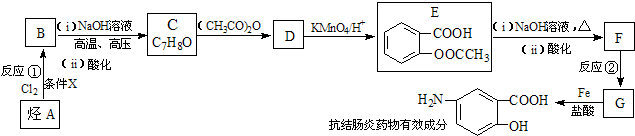
 ;
;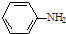 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸( 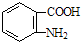 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)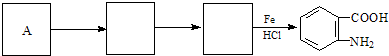
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 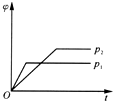 | B. | 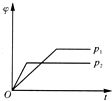 | C. | 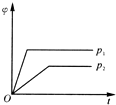 | D. | 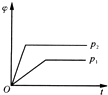 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦ | B. | ②④⑥ | C. | ①③⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
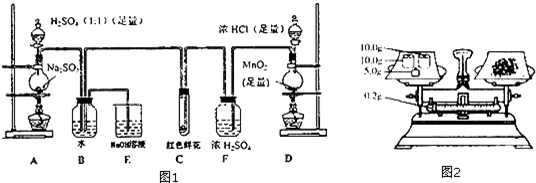
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| B. | 铝及其合金使用广泛,是因为铝比铁更耐酸、碱的腐蚀 | |
| C. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂△}^{O_{2}}$NO$→_{H_{2}O}^{O_{2}}$HNO3 | |
| B. | 浓HCl$→_{△}^{MnO_{2}}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$\stackrel{电解}{→}$Al | |
| D. | 淀粉$→_{△}^{H_{2}SO_{4}(aq)}$葡萄糖$\stackrel{酒化酶}{→}$C2H5OH$→_{Ag,△}^{O_{2}}$CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com