
判断正误,正确的划“√”,错误的划“×”
(1)在原电池中,发生氧化反应的一极一定是负极( )
(2)在原电池中,负极材料的活泼性一定比正极材料强( )
(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( )
(4)其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长( )
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
具有广泛用途的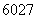 Co放射源首次实现了国内批量生产。另外,钴还有多种原子,如
Co放射源首次实现了国内批量生产。另外,钴还有多种原子,如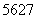 Co、
Co、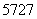 Co、
Co、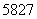 Co和
Co和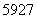 Co。下列关于钴原子的说法正确的是( )
Co。下列关于钴原子的说法正确的是( )
A.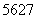 Co、
Co、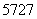 Co、
Co、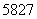 Co、
Co、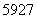 Co和
Co和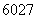 Co是摩尔质量不同的五种同素异形体
Co是摩尔质量不同的五种同素异形体
B.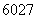 Co放射源可以用来治疗癌症,其中子数与电子数之差等于6
Co放射源可以用来治疗癌症,其中子数与电子数之差等于6
C.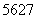 Co、
Co、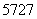 Co、
Co、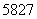 Co、
Co、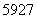 Co和
Co和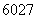 Co互为同位素,物理性质几乎相同,化学性质不同
Co互为同位素,物理性质几乎相同,化学性质不同
D.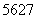 Co、
Co、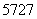 Co、
Co、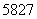 Co、
Co、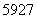 Co和
Co和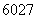 Co互为同分异构体
Co互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会生产、生活密切相关。下列说法正确的是( )
A.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
B.用聚氯乙烯作食品包装袋,有利于节约成本
C.制备乙酸乙酯时可用饱和Na2CO3溶液收集产物以除去其中的乙酸
D.“地沟油”禁止食用,但可以用来制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)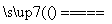 ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式)。产生这种结果的主要原因是________(用化学方程式和必要的文字加以说明)。
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
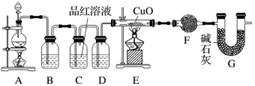
①装置B中加入的试剂为________,作用是________。
②装置D加入的试剂为________________,装置F加入的试剂为________________。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是________。
④U形管G的作用为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作小组同学将铜片加入稀硝酸中,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为____________________________________________________。
(2)提出合理假设,该实验中反应速率明显加快的原因可能是______(填字母)。
A.反应放热导致温度升高
B.压强增大
C.生成物的催化作用
D.反应物接触面积增大
(3)初步探究,测定反应过程中不同时间溶液的温度,结果如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是______________________________________。
(4)进一步探究:查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用。请完成以下实验设计表并将实验目的补充完整:
| 实验编号 | 铜片质量/g | 0.1 mol·L-1的硝酸体积/mL | 硝酸铜晶体/g | 亚硝酸钠晶体/g | 实验目的 |
| ① | 5 | 20 | |||
| ② | 0.5 | ||||
| ③ | 0.5 | 实验①和②探究____的影响;实验①和③探究NO |
答案 (1)3Cu+8H++2NO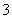 ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
(2)AC (3)温度不是导致反应速率明显加快的主要原因
(4)
| 实验编号 | 铜片质量/g | 0.1 mol·L-1的硝酸体积/mL | 硝酸铜晶体/g | 亚硝酸钠晶体/g | 实验目的 |
| ① | 0 | 0 | |||
| ② | 5 | 20 | 0 | ||
| ③ | 5 | 20 | 0 | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
电工经常说的一句口头禅:“铝接铜,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,试说明原因:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,下列说法正确的是( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S===6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如下图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
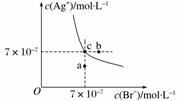
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
C.图中a点对应的是AgBr 的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com