
分析 (1)①FeS2中$\frac{2}{3}$的+2价Fe变为+3价Fe,-1价S变为0价,C由0价变为+2价,O由0价变为-2价,因此一个FeS2化合价升高$\frac{8}{3}$价,一个C化合价升高2价,一个O2化合价降低4价,O2得电子总数有3/4来自于C可知C与O2的化学计量数之比为3:2,FeS2的化学计量数为$\frac{3}{4}$,然后根据原子守恒配平并使化学计量数为正整数;
②根据硫元素的质量守恒进行计算;
(2)S8在充足的空气中燃烧生成二氧化硫;
(3)生成淡黄色沉淀是S,放出的气体能使品红溶液褪色,该气体是二氧化硫,写出反应物离子和生成物,然后配平;
(4)①在电解池中,阳极上发生氧化反应,SO42-在阳极放电生成S2O82-;
②Mn2+~MnO4-,化合价升高5,S2O82-~2SO42-,化合价降低2×1,根据得失电子守恒计算.
解答 解:(1)①FeS2中$\frac{2}{3}$的+2价Fe变为+3价Fe,-1价S变为0价,C由0价变为+2价,O由0价变为-2价,因此一个FeS2化合价升高$\frac{8}{3}$价,一个C化合价升高2价,一个O2化合价降低4价.由O2得电子总数有3/4来自于C,可知C与O2的化学计量数之比为3:2,假定C的化学计量数为3,O2的化学计量数为2,则FeS2的化学计量数为$\frac{4×2×(1-\frac{3}{4})}{\frac{8}{3}}$=$\frac{3}{4}$,然后化学计量数均扩大四倍,根据原子守恒可得3FeS2+12C+8O2═Fe3O4+12CO+6S,
故答案为:3;12;8;1;12;6;
②m吨黄铁矿中含有硫元素的质量为m×a%×$\frac{64}{120}$吨,在炼焦炉中硫的损失后剩余m×a%×$\frac{64}{120}$(1-b%)吨,
故答案为:m×a%×$\frac{64}{120}$(1-b%);
(2)S8在充足的空气中燃烧生成二氧化硫,化学方程式为S8+8O2$\frac{\underline{\;点燃\;}}{\;}$8SO2,
故答案为:S8+8O2$\frac{\underline{\;点燃\;}}{\;}$8SO2;
(3)硫代硫酸钠晶体遇酸反应生成淡黄色沉淀是S,放出的气体能使品红溶液褪色,该气体是二氧化硫,离子方程式为S2O32-+2H+=S↓+SO2↑+H2O,
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(4)①在电解池中,阳极上发生氧化反应,SO42-在阳极放电生成S2O82-,因此阳极电极反应式为2SO42--2e-=S2O82-,
故答案为:2SO42--2e-=S2O82-;
②Mn2+~MnO4-,Mn化合价升高5,S2O82-~2SO42-,一个S2O82-中S的合价共降低2×1,设1mol S2O82-氧化Mn2+可制得x mol MnO4-,根据得失电子守恒,
1mol×2=5×x mol,解得x=0.4,
故答案为:0.4.
点评 本题考查了氧化还原反应的应用,综合性很强,难度很大,涉及氧化还原反应的配平、依据得失电子相等的计算、方程式的书写等问题,其中(1)配平难度较大.


科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Cu2S只是还原剂 | |
| B. | 每生产1molCu需转移2mol电子 | |
| C. | 该反应中SO2既是氧化产物又是还原产物 | |
| D. | 若用该反应生产铜,全世界每年产生的SO2的体积为1.4×106L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.2molNa2O2中含有0.4NA个阴离子 | |
| B. | 常温常压下,0.2molSi与足量NaOH溶液反应,转移电子的数目为0.2NA | |
| C. | 物质的量浓度为0.5mol/L的FeCl3溶液中,含有Cl-个数为1.5NA | |
| D. | 常温常压下,1.06g Na2CO3中含有的Na+离子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
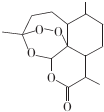
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素可溶于NaOH溶液,可使酸性高锰酸钾溶液褪色 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱:苛性钠、纯碱、熟石灰 | |
| B. | 碱性氧化物:氧化铜、七氧化二锰、氧化铝 | |
| C. | 盐:胆矾、小苏打、铜绿 | |
| D. | 无丁达尔现象的分散系:碘的四氯化碳溶液、淀粉溶液、氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com