
为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH (CH3COOH) | CaO | 蒸馏 |
| D | CO2(SO2) | Na2CO3溶液 | 洗气 |
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
下列的离子方程式中,书写正确的一项是( )
A.氨水中通入过量CO2:2NH3·H2O +CO2==== 2NH4++CO32-+H2O
B.稀硝酸中加入过量铁粉:3Fe + 8H++2 NO3-==== 3Fe2++ 2NO↑ + 4H2O
C.钠与水反应 Na+2H2O==== Na+ +2OH-+H2 ↑
D.Ca(ClO)2 溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O==== HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25℃时,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子 方程式为_____________________。
方程式为_____________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,
Ksp[Al(OH)3]=3×10-34。)
(2)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb=________。
(3)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(4)(2013·山东高考)25℃时,H2SO3HSO +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中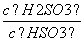 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分离或除杂的方法不正确的是
( )
A.用分液法分离水和酒精
B.用蒸馏法分离苯和溴苯
C.用重结晶方法提纯苯甲酸
D.用饱和碳酸氢钠溶液除去二氧化碳中混有的少量氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案不合理的是
( )
A.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸等
B.分离苯和硝基苯的混合物,可用蒸馏法
C.可用苯将溴从溴苯中萃取出来
D.可用水来鉴别苯、乙醇、四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛在医药、染料、香料等行业中都有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛,试回答下列问题。
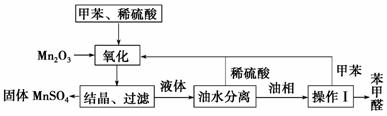
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是__________________
______________________________________________________。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的是________________________________________________
________________________。
(3)实验过程中,可循环使用的物质有________、________。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是______,其原理是__________
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关胶体和溶液的比较中,正确的是( )
A.溶液呈电中性,胶体带有电荷
B.溶液可透过滤纸,胶体不可透过滤纸
C.溶液中通过光束没有特殊现象,胶体中通过光束有丁达尔现象
D.胶体与溶液的本质区别是胶体有丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )
A. Na+ B.SO42- C. Ba2+ D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
某种盐溶解后得到的溶液中,可能含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学做如下实验:①取少量溶液于试管中,逐滴加入浓氢氧化钠溶液,发现先生成白色沉淀,迅速变为灰绿色,最后变为红褐色,并有刺激性气体生成;②另取少量溶液于试管中,加入少量盐酸酸化的氯化钡溶液,有白色沉淀生成。
该溶液中一定含有的离子是 ;写出①中白色沉淀转化为红褐色沉淀的化学方程式 。
(2)乙同学做如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色;继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,他查阅资料知:H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+(SCN-中S为-2价)
①该反应中,被氧化的元素为 ,每生成lmol CO2转移的电子数为 NA;
② 根据乙同学的实验现象,请判断还原性强弱为:Fe2+ SCN-(填<、=或>);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com