
臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)= 3Ag2O(s); △H=-236kJ·mol-1,
已知:2Ag2O(s)= 4Ag(s)+O2(g); △H=" +62" kJ·mol-1,
则O3转化为O2的热化学方程式为________________________________________________。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下表所示。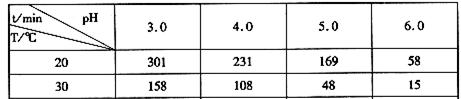
由上表可知pH增大能加速O3分解,表明对O3分解起催化作用的是__________(填微粒符号)。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。
臭氧在阳极周围的水中产生,其电极反应式为_______________________;阴极附近的氧气则生成过氧化氢,其电极反应式为_______________________。
(1)2O3=3O2 △H="-286kJ/mol" (3分)(2)OH- (1分)
(3)3H2O-6e-=O3↑+6H+ (3分) 3O2+6H++6e-=3H2O2(3分)
解析试题分析:(1)①6Ag(s)+O3(g)=3Ag2O(s)△H=-235.8kJ?mol-1,②2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJ?mol-1,根据盖斯定律可知①×2+②×3可得到,2O3(g)=3O2(g),则反应热△H=(-235.8kJ?mol-1)×2+(+62.2kJ?mol-1)×3=-285kJ/mol,所以热化学方程式为2O3(g)=3O2(g)△H=-285kJ/mol(2)由表格中的数据可知,相同温度下,pH越大,O3分解速率越大,表明对O3分解起催化作用的是OH-(3) 酸性条件下电解水的方法制得臭氧.臭氧在阳极周围的水中产生,其电极反应式为3H2O-6e-=O3↑+6H+,阴极附近的氧气则生成过氧化氢,其电极反应式为3O2+6H++6e-=3H2O2
考点:热化学方程式;化学反应速率的影响因素;电解原理


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
运用化学反应原理知识在工业生产中有重要意义。
(1) 工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下: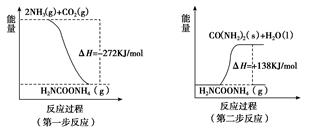
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________ _____。
(2)工业生产中用CO可以合成甲醇CO(g)+2H2(g)  CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_ ____(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(3)工业生产中用SO2为原料制取硫酸
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式___ ____________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式____ ______。
(4)工业生产中用氨水吸收SO2
若将等物质的量的SO2与NH3溶于水充分反应,写出该反应的离子方程式 ,所得溶液呈 性。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨在国民经济中占有重要地位。
(1)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量。
① 工业合成氨的热化学方程式是 。
② 已知:
N2 (g)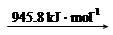 2N (g)
2N (g)
H2 (g)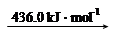 2H (g)
2H (g)
则断开1 mol N-H键所需的能量是_______kJ。
(2)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
① 曲线a对应的温度是 。
② 关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③ M点对应的H2转化率是 。 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。
则该燃料电池的负极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请回答下列问题:
①已知:①CO(g) + 1/2O2(g) = CO2(g) △H= -283.0kJ·mol-1
②CH3OH(l) + 3/2O2(g) = CO2(g)+2H2O(l) △H= -726.5kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________________________________________________________;
②已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应则反应:H2(g)+ Cl2(g)=2HCl (g) 的△H= 。
(2)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①则表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为: 。
②测定中和热实验时所需的玻璃仪器有烧杯、量筒、 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)  2NO(g) ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
2NO(g) ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
请回答:
(1)已知:N2(g)+2O2(g)  2NO2(g) ΔH1 2NO2(g)
2NO2(g) ΔH1 2NO2(g)  O2+2NO(g) ΔH2 ΔH= (用含ΔH1、ΔH2的表达式表示);
O2+2NO(g) ΔH2 ΔH= (用含ΔH1、ΔH2的表达式表示);
(2)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO的反应速率 ;
(3)假定该反应是在恒容条件下进行,下列能判断该反应已达到平衡的是________;
| A.消耗1 mol N2同时生成1 mol O2 |
| B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
| D.2v正(N2)=v逆(NO) |
 2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为 反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;
2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为 反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;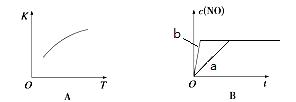
 2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)
2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。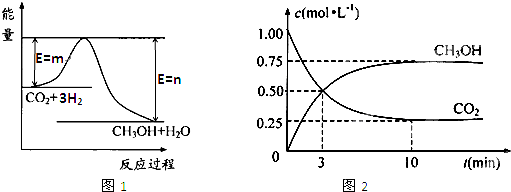
(1)写出该反应的热化学方程式 。
(2)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为: 。
(4)温度降低,平衡常数K (填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
(6)下列措施中能使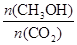 增大的有 。
增大的有 。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.体积不变,充入He(g)使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ在催化剂作用下,CO2和H2可以制取甲醇。用工业废气中的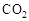 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
写出由二氧化碳和氢气制备甲醇的热化学方程式: 。
Ⅱ硼氢化钠(NaBH4)是有机合成中的重要还原剂。最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
(1)电极b为 (填“正极”或“负极”),电极a上发生反应的电极反应式为 。
(2)电池工作时,Na+向 极(填“a”或“b”)移动,当左槽产生0.0125molBO2—离子时,右槽溶液pH=
(3)用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1molCu(OH)2,溶液恢复到电解之前状态,则电解过程中转移电子数目为_________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“节能减排”,减少全球温室气体排放,意义十分重大。二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的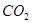 。
。
(1)使用过量 溶液吸收
溶液吸收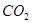 ,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L
,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L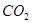 气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
(2)①以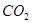 和
和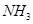 为原料可合成化肥尿素[
为原料可合成化肥尿素[ ]。已知:
]。已知:
 ①
①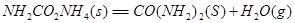
 ②
②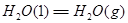
 ③
③
试写出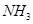 和
和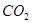 合成尿素和液态水的热化学方程式__________。
合成尿素和液态水的热化学方程式__________。
②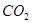 通过反应可转化为
通过反应可转化为 ,在催化剂作用下CO和
,在催化剂作用下CO和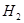 反应生成甲醇:
反应生成甲醇: 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol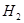 ,CO的平衡转化率(a)与温度、压强的关系如下图所示。
,CO的平衡转化率(a)与温度、压强的关系如下图所示。
A.若A点表示在某时刻达到的平衡状态,此时容器的容积为VL,则该温度下的平衡常数K=__________;平衡状态B点时容器的容积 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)
B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间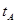 _______
_______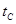 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
C.在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H—H | 436 |
| O—H | 463 |
| O=O | 498 |
| 实验编号 | 反应物 | 催化剂 | |
| a | 50 mL 5% H2O2溶液 | | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| b | 50 mL 5% H2O2溶液 | 少量浓盐酸 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| c | 50 mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| d | 50 mL 5% H2O2溶液 | | MnO2 |
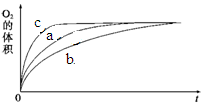
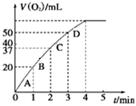
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com