
若两物质恰好完全反应,下列各项中反应前后保持不变的是
①电子总数;②原子总数;③分子总数;④物质的总能量;⑤物质的总质量
A.①②⑤ B.①③⑤ C.②③④ D.②④⑤
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014学年湖南省十三校高三第二次联考理综化学试卷(解析版) 题型:填空题
(12分)下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下的气态化合物,C为常温下的液态化合物,图中有部分生成物未标出。
请填写以下空白:

(1)A的化学式为 ,B的电子式为 。
(2)写出下列反应的化学方程式:
D+G→H 。
F+J→B+C+I 。
(3)0.3 mol I与足量C反应转移电子的物质的量为 mol。
(4)容积为10 mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I与G的体积分别为 mL, mL。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2 L H2O中氧原子的数目大于0.5 NA
B.6.0 g醋酸晶体中含有H+的数目为0.1 NA
C.64gCu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA
D.1 mol Cl-含有的核外电子总数为8 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第一次模拟考试卷理综化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法正确的是( )
①乙醇汽油是在汽油中加入适量乙醇作为汽车燃料,可节省石油资源,减少汽车尾气对空气的污染。
②聚乙烯塑料的老化是由于发生了加成反应。
③煤经过气化和液化等物理变化可以转化为清洁燃料。
④合成纤维、人造纤维及碳纤维都属于有机高分子材料。
⑤利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程。
⑥“地沟油”禁止食用,但可以用来制肥皂。
A.①②③ B.①④⑤ C.①⑤⑥ D.③④⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省南昌市高三3月第一次模拟考试理综化学试卷(解析版) 题型:选择题
已知一定温度下,有下列难溶电解质的相关数据
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
KSP/250C | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A.向该混合溶液中加过量铁粉,能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该混合溶液中c(SO42-):[c(Cu2+)+ c(Fe2+)+ c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氯水,并调pH至3~4后过滤,能得到纯净的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:填空题
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤。请回答下列问题:
(1)该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)某温度下,2SO2(g)+O2(g)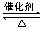 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。

(4)将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:



X Z
下列有关叙述中不正确的是
A.Z结构中有4个手性碳原子
B.Y的分子式为C9H8O3
C.1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH
D.Z与浓溴水既能发生取代反应又能发生加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是

A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
下列过程的离子方程式正确的是
A.用烧碱溶液吸收Cl2:Cl2+2OH- =Cl-+ClO-+H2O
B.用饱和Na2CO3溶液转化锅垢中的CaSO4:CaSO4(s)+CO32- (aq)=CaCO3(s)+SO42-(aq)
C.实验室制备Fe(OH)3胶体:Fe3+ +3OH- =Fe(OH)3↓
D.金属Na与水反应:Na +2H+ = H2↑+Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com