
【题目】三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·xH2O}是一种光敏材料,为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量4.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO![]() 被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO![]() 被还原成Mn2+。
被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液19.98 mL。
请回答下列问题:
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、________、转移、洗涤并转移、________、摇匀。
(2)加入锌粉的目的是________________ ___。
(3)写出步骤三中发生反应的离子方程式:________________________。
(4)实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量________。(选填“偏低”、“偏高”或“不变”)
【答案】(1)溶解(1分)定容(1分)
(2)将Fe3+还原为Fe2+(2分)
(3)8H++MnO![]() +5Fe2+=Mn2++5Fe3++4H2O(2分)
+5Fe2+=Mn2++5Fe3++4H2O(2分)
(4)14.00%(或0.14) (2分) 偏高(2分)
【解析】试题分析:(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、转移、洗涤并转移、定容、摇匀。
(2)步骤二中加入锌粉至黄色刚好消失,目的是将Fe3+恰好还原成Fe2+;
(3)在步骤三中MnO4-将Fe2+氧化为Fe3+,根据电子守恒、电荷守恒及原子守恒,发生反应的离子方程式是8H++MnO![]() +5Fe2+=Mn2++5Fe3++4H2O;
+5Fe2+=Mn2++5Fe3++4H2O;
(4)消耗KMnO4溶液体积的平均值为20.00 mL ,n(Fe2+) :n(MnO4-) =5 :1,n(MnO4-)=0.010 mol/L ×0.02L =0.0002 mol,所以n(Fe2+) =5n(MnO4-) =5 ×0.0002mol =0.001mol,所以250 mL溶液中Fe的质量是m(Fe) =0.001 mol ×(250 ÷25) ×56 g/mol =0.56g,该晶体中铁元素的质量分数为(0.56g ÷4.00 g) ×100%= 11.400%;若步骤二中加入的KMnO4的溶液的量不足,则溶液中还存在部分草酸根离子,在第三步消耗的KMnO4溶液体积偏大,使的测得的铁含量偏高。


科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,运用铁及其化合物的知识,完成下列问题。
(1)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________。某问学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少最待侧溶液,滴入KSCN溶液后显红色。由此可知,该溶液中所含金属阳离子有_________。
(2)欲从废液中回收铜,并重新获得FeCl3溶液。某同学设计如下实验方案:

①写出上述实验中有关物质的化学式:A_______;B___________。
②写出通入气体C的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
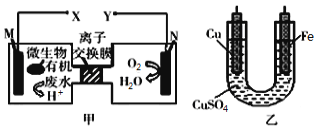
A.质子透过离子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极反应式:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+
D.当N电极消耗0.25mol气体时,则铁电极增重16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几组实验中,能够达到目的的是( )
A. 实验一:向饱和AlCl3溶液中滴加氨水以制备Al(OH)3胶体
B. 实验二:用饱和NaHCO3溶液除去混在Cl2中的HCl气体
C. 实验三:用Na2O2与水反应制氧气
D. 实验四:用Cl2除去Fe2(SO4)3溶液中的少量FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个1 L的密闭容器中,加入2 mol A和1 mol B,发生下列反应:2A(g)+B(g) ![]() 3C(g)+D(s),10min后达到平衡,平衡时C的速率为0.12 mol/(L。min)。
3C(g)+D(s),10min后达到平衡,平衡时C的速率为0.12 mol/(L。min)。
(1)维持容器的温度不变,若缩小容器的体积,则平衡____________移动(填“向正反应方向”或“向逆反应方向”或“不”)。
(2)维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍与上述平衡相同的是____________。
A.4 mol A+2 mol B
B.3 mol C+1 mol D
C.2 mol A+1 mol B+1 mol D
(3)若维持容器内的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度与上述平衡相同,则C的起始物质的量应满足的条件是____________。
(4)到达平衡时B的转化率为 。若到达到平衡后向容器中加入少量的C,其它条件保持不变,B的转化率将 (填“变大”或“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互混合反应,最终有白色沉淀生成的是( )
①将SO2通入Na2SiO3溶液中
②过量氨水和明矾溶液混合
③Ca(HCO 3)2溶液中投入Na2O2固体
④NaAlO2溶液中通入过量CO2
⑤Na2O2投入FeCl2溶液中
A. ①②③④ B. ①③④⑤ C. ①②④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:2NO(g) = N2(g)+O2(g) △H=﹣180.5kJmol-
C(s)+O2(g)=CO2(g) △H=﹣393.5 kJmol-
2C(s)+O 2(g)=2CO(g) △H=﹣221kJmol-
若某反应的平衡常数表达式为:![]() ,请写出此反应的热化学方程式 。
,请写出此反应的热化学方程式 。
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/(molL-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①2.00min~5.00 min内,NO2的平均反应速率为 ;已知气体的物质的量与体系压强成正比,若反应开始时体系压强为P0,第4.00 min时体系压强为P1,则P1∶P0= ;
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是 。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的密度保持不变
II.双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2 ![]() O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。
O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍。下列说法正确的是
A. 元素A、C的最高价氧化物对应的水化物都是弱酸
B. 元素B的单质能与A的最高价氧化物发生置换反应
C. 元素B和D能形成BD2型的共价化合物
D. 元素C、D不可能形成含有非极性键的共价分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com