
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价] | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | L2+与R2-的核外电子数相等 | D. | M与T形成的化合物具有两性 |
分析 短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素.
A.分子间含有氢键的沸点较高;
B.金属性越强,与酸反应越剧烈;
C.阴离子的电子数=质子数+电荷数,阳离子的电子数=质子数-电荷数;
D.M与T形成的化合物是氧化铝,属于两性氧化物.
解答 解:短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素,
A.分子间含有氢键的沸点较高,水分子间存在氢键沸点较高,则氢化物的沸点为H2S<H2O,故A错误;
B.金属性Mg>Be,则Mg与酸反应越剧烈,即单质与稀盐酸反应的速率为Be<Mg,故B错误;
C.L2+的核外电子数为12-2=10,R2-的核外电子数为16+2=18,不相等,故C错误;
D.M与T形成的化合物是氧化铝,属于两性氧化物,故D正确.
故选D.
点评 本题考查元素的性质,学生能利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可,难度不大.


科目:高中化学 来源: 题型:解答题
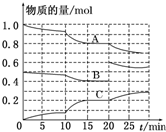 在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗是一种金属性很强的元素 | B. | 锗化氢(GeH4)稳定性很强 | ||
| C. | 锗酸(H4GeO4)是难溶于水的强酸 | D. | 锗元素位于第四周期第ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{88}^{226}$Ra原子核内有138个中子 | B. | ${\;}_{88}^{226}$Ra原子核外有88个电子 | ||
| C. | ${\;}_{88}^{226}$Ra原子核内有88个质子 | D. | Ra元素位于第六周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
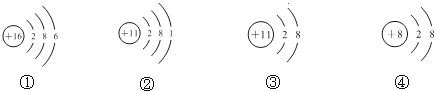
| A. | 它们表示三种元素 | |
| B. | ②③的化学性质相同 | |
| C. | ②表示的元素是金属元素 | |
| D. | ①表示的是原子,而④表示的是阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物的分子式为CH4 | B. | 该有机物中含碳元素和氢元素 | ||
| C. | 该有机物中只含有碳元素和氢元素 | D. | 该有机物的化学性质比较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol O2与Na完全反应,转移电子数一定为4NA | |
| B. | 常温常压下,1.7克NH3中含有共价键的数目为NA | |
| C. | 142g Na2SO4和Na2HPO4混合物中含有的阴、阳离子总数是3 NA | |
| D. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com