
| A、3种溶液pH的大小顺序是 ③>②>① |
| B、若将此3种溶液稀释相同倍数,pH变化最大的是② |
| C、若分别逐滴加入25mL 0.1 mol?L-1盐酸后,反应后所得溶液pH最大的是① |
| D、以上3种溶液中水的电离程度相同 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 |
| B、Na2O |
| C、Na2S |
| D、Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸钠溶液的pH>7 |
| B、常温下,0.1 mol?L-1醋酸溶液pH=2.5 |
| C、醋酸能使紫色石蕊试液变红 |
| D、pH=3的醋酸溶液稀释100倍后pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棕红色NO2加压后颜色先变浅后变深 |
| B、向Fe(SCN)3溶液中加入少量KSCN固体,溶液红色变浅 |
| C、把装有NO2气体的烧瓶放入冰水中,气体红棕色变深 |
| D、向新制AgCl悬浊液中滴入Na2S溶液,振荡后沉淀可以由白色变为黑色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
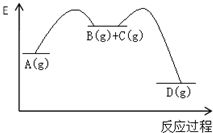 对于如下反应,其反应过程的能量变化示意图如图:
对于如下反应,其反应过程的能量变化示意图如图:| 编号 | 反应 | 平衡常数 | 反应热 |
| 反应① | A(g)=B(g)+C(g) | K1 | △H1 |
| 反应② | B(g)+C(g)=D(g) | K2 | △H2 |
| 反应③ | A(g)=D(g) | K3 | △H3 |
| A、K3=K1+K2 |
| B、△H3=△H1+△H2 |
| C、加催化剂,反应①的反应热降低,反应速率加快 |
| D、则增大压强,K1减小,K2增大,K3不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g)═CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g)═CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A、温度:T1>T2>T3 |
| B、正反应速率:υ(a)>υ(c) υ(b)>υ(d) |
| C、平衡常数:K(a)>K(c) K(b)=K(d) |
| D、平均摩尔质量:M(a)<M(c) M(b)<M(d) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com