
| A. | 利用H++OH-═H2O來测量某氢氧化钠溶液的浓度时:甲基橙--橙色 | |
| B. | 利用“2Fe3++2I-═I2+2Fe2+,用NaI溶液测量Fe(NO3)3样品中Fe(NO3)3百分含量:淀粉--蓝色 | |
| C. | 利用“Ag++SCN-=AgSCN↓原理,可用标准KSCN溶液含量AgNO3溶液浓度:Fe(NO3)3--血 红色 | |
| D. | 用标准酸性KMnO4溶液滴定NaHSO3溶液以测量其浓度:KMnO4--紫红色 |
分析 根据滴定的原理以及试剂的颜色判断终点的到达来分析.
A.滴定终点前,溶液显碱性,加入甲基橙,溶液呈黄色,到达滴定终点,溶液变成橙色;
B.一开始就生成了单质碘,溶液呈蓝色;
C.KSCN溶液遇Fe(NO3)3呈血红色;
D.KMnO4本身就是指示剂,为紫红色;
解答 解:A、用标准的盐酸溶液滴定氢氧化钠溶液,甲基橙为指示剂,溶液由黄色变为橙色为终点的到达,故A正确;
B、利用2Fe3++2I-═I2+2Fe2+原理,由于一开始就生成了单质碘,溶液呈蓝色,无法判断终点,故B错误;
C、利用Ag++SCN-═AgSCN↓原理,可用标准KSCN溶液测量AgNO3溶液浓度,Fe(NO3)3为指示剂,溶液由无色变为血红色为终点的到达,故C正确;
D、用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度,KMnO4本身就是指示剂,溶液由无色变为紫红色为终点的到达,故D正确;
故选B.
点评 本题主要考查了指示剂的原理以及终点的现象,抓住实验的原理是解题的关键,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨水中铵根离子和氢氧化钠溶液中钠离子浓度相等 | |
| B. | 温度下降10℃,两溶液的pH均不变 | |
| C. | 氨水和氢氧化钠溶液的浓度相等 | |
| D. | 分别与等浓度的盐酸反应,氨水消耗盐酸的体积与氢氧化钠消耗盐酸的体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
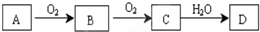
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
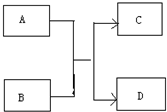 运用有关知识,回答下列问题.
运用有关知识,回答下列问题.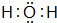 ,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.
,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
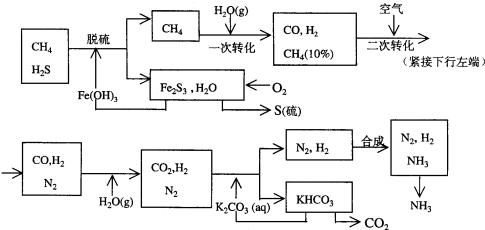
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂发生还原反应 | B. | 一定有氧元素参与反应 | ||
| C. | 一定有元素化合价升降 | D. | 氧化剂失去电子,化合价升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com