
| A.质子数 | B.中子数 | C.质量数 | D.电子层数 |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

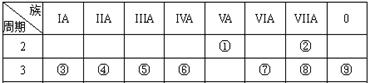

 的非金属元素是________,二者形成的化合物的电子式为
的非金属元素是________,二者形成的化合物的电子式为 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____>_____>______>______。(用“离子符号”表示)
W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____>_____>______>______。(用“离子符号”表示)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| X | Y | |
| | Z | W |
 。
。 ,每转移4mol电子放热190.0kJ,该反应的热化学方程式是 。
,每转移4mol电子放热190.0kJ,该反应的热化学方程式是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X的离子半径比Y的大 |
| B.X原子的最外层电子数比Y的多 |
| C.X的原子半径比Y的大 |
| D.X元素的最高正价比Y的小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
| B.碳和硅都是IVA族元素,Si和SiO2都是原子晶体; 则C和CO2也是原子晶体 |
| C.卤族元素最高价氧化物的水化物酸性:HClO4>HBrO4>HIO4;则也有酸性:盐酸>氢溴酸>氢碘酸 |
| D.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 原子更容易失去电子
原子更容易失去电子| A.全部 | B.①⑤⑥⑦⑧ | C.①②③⑦⑧ | D.①④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com