
| A.12.96g | B.3.24g | C.6.48g | D.1.62g |
科目:高中化学 来源:不详 题型:填空题
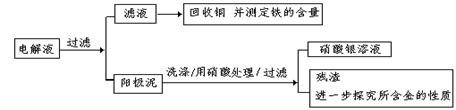
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
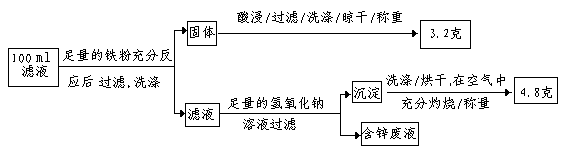
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgNO3 | B.H2O | C.Ag2O | D.Ag(NH3)2OH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

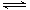 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
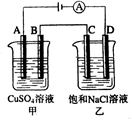
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
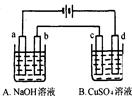
| A.4 | B.3 | C.2 | D.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
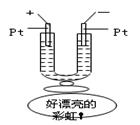
| A.蓝、紫、红 | B.红、蓝、紫 |
| C.红、紫、蓝 | D.紫、红、蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.77.6 g | B.80g | C.92 g | D.82.7 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com