
【题目】将70g氧化钠与过氧化钠的混合物投入到100g水中,所得到的溶液的质量为162g,则原混合物中氧化钠的质量为__________g。
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于“甲烷燃烧”的叙述中错误的是( )
A. 甲烷在空气中燃烧时火焰呈淡蓝色
B. 甲烷燃烧一定只生成二氧化碳和水
C. 甲烷燃烧放出大量的热,常用作气体燃料
D. 点燃甲烷前要先检验其纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是
A. 乙烯使酸性KMnO4溶液褪色B. 将苯滴入溴水中,振荡后水层接近无色
C. 乙烯使溴水褪色D. 甲烷与Cl2混合,光照后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式为 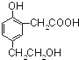 ,用等物质的量的该有机物分别与Na、NaOH,NaHCO3反应时,则消耗Na、NaOH,NaHCO3的物质的量之比为( )
,用等物质的量的该有机物分别与Na、NaOH,NaHCO3反应时,则消耗Na、NaOH,NaHCO3的物质的量之比为( )
A.3:2:1
B.3:1:1
C.1:1:1
D.3:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,写出除去下列物质中的杂质的方法,并写出化学方程式(括号内的气体为杂质). 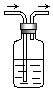
(1)CO2( SO2) , 化学方程式 .
(2)SO2 ( HCl ) , 化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A. 灼热的木炭与CO2反应B. 锌粒与稀硫酸的反应
C. 碳酸钙的高温分解D. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。 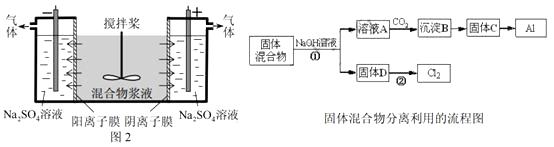
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为。B→C的反应条件为 , C→Al的制备方法称为。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化,加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)。 a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为。
(4)Ⅱ.含铬元素溶液的分离和利用 用惰性电极电解时, ![]() 能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式)。
能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com