
分析 (1)等物质的量的醋酸和NaOH恰好完全反应生成醋酸钠,溶液呈碱性,说明醋酸是弱酸,醋酸根离子水解导致溶液呈碱性;
(2)根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),
根据物料守恒得c(Na+)=c(CH3COOH)+c(CH3COO-),
所以得c(CH3COOH)=c(OH-)-c(H+);
(3)CH3COONH4溶液呈中性,说明CH3COO-水解程度和NH4+水解程度相同;CO32-水解程度大于CH3COO-,所以①溶液呈碱性;
②溶液呈中性;
③④中NH4+水解程度相同,两种溶液都呈酸性,但④中NH4+浓度大,所以pH③<④;
(4)为了证明Mg(OH)2悬浊液与氯化铵溶液的反应原理,可加入醋酸铵溶液检验,因醋酸铵溶液呈中性,如甲同学的解释正确,则氢氧化镁不溶解,如氢氧化镁溶解,则乙同学的解释正确;
(5)CH3COONH4溶液呈中性;
(6)丙同学将所选试剂滴加到Mg(OH)2悬浊液中,Mg(OH)2溶解,说明氢氧化镁和铵根离子反应而使氢氧化镁溶解;
(7)通过以上分析知,氢氧化镁溶于铵盐,但氢氧化不溶于铵盐,可以用铵盐除去氢氧化镁;氢氧化铝能溶于强碱,但氢氧化镁不溶于强碱,所以可以用强碱溶液除去氢氧化铝.
解答 解:(1)等物质的量的醋酸和NaOH恰好完全反应生成醋酸钠,溶液呈碱性,说明醋酸是弱酸,醋酸根离子水解导致溶液呈碱性,水解方程式为CH3COO-+H2O?CH3COOH+OH-,故答案为:CH3COO-+H2O?CH3COOH+OH-;
(2)根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),
根据物料守恒得c(Na+)=c(CH3COOH)+c(CH3COO-),
所以得c(CH3COOH)=c(OH-)-c(H+)=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L-10-9mol/L=(1×10-5-1×10-9)mol/L,故答案为:(1×10-5-1×10-9);
(3)CH3COONH4溶液呈中性,说明CH3COO-水解程度和NH4+水解程度相同;CO32-水解程度大于CH3COO-,所以①溶液呈碱性;
②溶液呈中性;
③④中NH4+水解程度相同,两种溶液都呈酸性,但④中NH4+浓度大,所以pH③<④,
通过以上分析知,溶液pH大小顺序是①②④③,
故答案为:①②④③;
(4)硝酸铵和氯化铵相似,只有铵根离子的水解,而碳酸钠和氨水溶液都呈碱性,只有B符合,
故答案为:B;
(5)CH3COONH4溶液呈中性,不存在甲同学观点中条件,以此确认乙同学的观点是否正确,
故答案为:CH3COONH4溶液呈中性,不存在甲同学观点中条件,以此确认乙同学的观点是否正确;
(6)丙同学将所选试剂滴加到Mg(OH)2悬浊液中,Mg(OH)2溶解,说明氢氧化镁和铵根离子反应而使氢氧化镁溶解,离子方程式为Mg(OH)2+2 NH4+═Mg2++2NH3•H2O,故答案为:乙;Mg(OH)2+2 NH4+═Mg2++2NH3•H2O;
(7)通过以上分析知,氢氧化镁溶于铵盐,但氢氧化不溶于铵盐,可以用铵盐除去氢氧化镁,如NH4NO3(或CH3COONH4等铵盐均可);氢氧化铝能溶于强碱,但氢氧化镁不溶于强碱,所以可以用强碱溶液除去氢氧化铝,如NaOH溶液等,
故答案为:NH4NO3(或CH3COONH4等铵盐均可);NaOH溶液等.
点评 本题考查弱电解质的电离及盐类水解,为高频考点,试题侧重于考查学生的实验探究能力和分析能力,注意(3)题氯化铵和硫酸铵溶液pH大小比较方法,为易错点.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入少量盐酸 | B. | 加入适量的水 | C. | 加入适量的KOH | D. | 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中c(NH4+)与c(NH2-)的乘积总为一定值 | |
| B. | 液氨的电离达到平衡时,c(NH3)=c(NH4+)=c(NH2-) | |
| C. | 只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等 | |
| D. | 液氨中含有NH3、NH4+、NH2-、H2O、NH3•H2O等微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量烧碱固体 | B. | 降低温度 | C. | 加少量冰醋酸 | D. | 加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入大量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取浓盐酸时俯视量筒刻度进行读数 | |
| B. | 定容时俯视容量瓶瓶颈刻度线 | |
| C. | 溶解搅拌时有液体飞溅 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
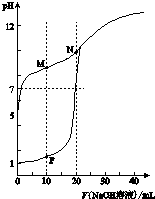 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )| A. | HX为弱酸 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液为混合,呈酸性 | |
| D. | 向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-)>c(X-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
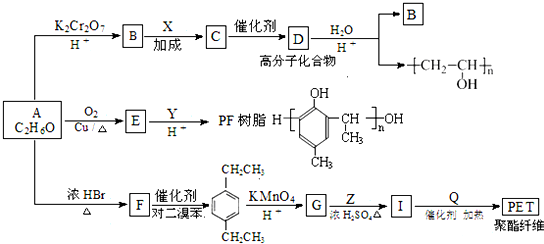
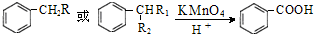 (R为H原子或烃基)
(R为H原子或烃基)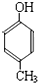
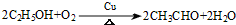
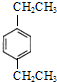 的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为
的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为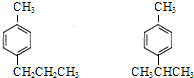

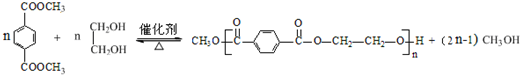 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com