
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
| A. | 已知t1>t2,HX的生成反应为放热反应 | |
| B. | 在相同条件下,X2平衡转化率a:F2>Cl2 | |
| C. | X2与H2反应的剧烈程度随着原子序数递增逐渐减弱 | |
| D. | HX的稳定性:HBr>HI |
分析 A.升高温度,平衡向吸热反应方向移动;
B.相同条件下,转化率越大,平衡常数越大;
C.反应条件越苛刻,其单质与氢气反应程度越不剧烈;
D.平衡常数越大,说明生成的氢化物越稳定.
解答 解:A.温度升高HX的生成反应的平衡常数减小,说明升高温度,平衡逆向移动,则HX的生成反应为放热反应,故A正确;
B.在相同条件下,HF的生成平衡常数大于HCl的生成的平衡常数,说明平衡转化率F2>Cl2,故B正确;
C.缺少反应条件,仅根据平衡常数,不能判断反应的剧烈程度,故C错误;
D.反应正向进行的程度越大,说明生成的氢化物越不易分解,越稳定,所以HX的稳定性HBr>HI,故D正确;
故选C.
点评 本题以卤族元素为例考查化学平衡常数意义,明确平衡常数内涵是解本题关键,注意平衡常数只能说明反应进行程度但不能说明反应剧烈程度,易错选项是C.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按以下步骤从
按以下步骤从 合成
合成  .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去) 、D
、D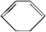 .
.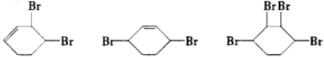 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O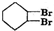 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 同一短周期内主族元素最高价氧化物对应水化物相同浓度稀溶液的pH与原子半径的关系如图,下列说法正确的是( )
同一短周期内主族元素最高价氧化物对应水化物相同浓度稀溶液的pH与原子半径的关系如图,下列说法正确的是( )| A. | 原子序数:W>Z>X | |
| B. | 气态氢化物的稳定性:N>R | |
| C. | Y和W形成共价化合物 | |
| D. | X和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
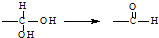 ,下列有关有机物
,下列有关有机物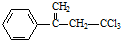 的说法不正确的是( )
的说法不正确的是( )| A. | 属于卤代烃,能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质存在顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与4molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知H2O2分子的结构如图所示,此分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,试推测H2O2可能具有的性质是( )
已知H2O2分子的结构如图所示,此分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,试推测H2O2可能具有的性质是( )| A. | H2O2分子为非极性分子 | B. | H2O2易溶于CS2 | ||
| C. | H2O2分子中只含σ键 | D. | H2O2分子中只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间消耗nmol A,同时生成2nmolC | |
| B. | A,B,C的分子数之比为1:2:3 | |
| C. | A,B,C的浓度相等 | |
| D. | 生成C的速率与分解C的速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com