
| A. | H+、CO32-、Na+ | B. | Na+、OH-、SO42- | C. | Cu2+、OH-、H+ | D. | Ba2+、SO42-、Cl- |
科目:高中化学 来源: 题型:解答题

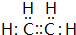 ,实验室制备该气体的化学方程式为CH3CH2OH$→_{浓硫酸}^{170℃}$C2H4↑+H2O
,实验室制备该气体的化学方程式为CH3CH2OH$→_{浓硫酸}^{170℃}$C2H4↑+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为加快过滤速度,可用玻璃棒在过滤器中搅拌 | |
| B. | 胶体、溶液、浊液分属不同类别的本质是其透过滤纸的性质不同 | |
| C. | 分液漏斗和容量瓶使用前都需要检查是否漏液 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{W•1000•ρ}{M}$ | B. | m=V•ρ•$\frac{W}{100}$ | C. | W%=$\frac{c×M}{1000×ρ}$% | D. | c=$\frac{m}{V•M}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
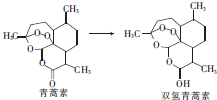
| A. | 青蒿素中氧元素的质量为80g | B. | 双氢青蒿素能发生酯化反应 | ||
| C. | 双氢青蒿素能与溴水发生加成反应 | D. | 青蒿素和双氢青蒿素均含羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com