
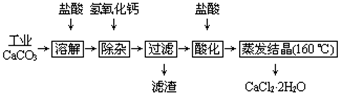
| 0.588 |
| 0.75 |


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
| A、滴定管出口部分开始有气泡,滴定后气泡消失 |
| B、锥形瓶用蒸馏水冲洗后随即使用 |
| C、当看到锥形瓶中溶液的颜色发生变化后随即停止了滴定 |
| D、滴定管在用蒸馏水洗净后,即装入标准的酸溶液进行滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验目的 | 实验操作 |
| A | 测定某溶液的pH | 用玻璃棒蘸取该溶液点在pH试纸中间 |
| B | 加快锌与稀硫酸制取H2的速率 | 在稀硫酸中滴加少量CuSO4溶液 |
| C | 证明醋酸是弱电解质 | 将CH3COONa晶体加入水中,会促进水的电离平衡 |
| D | 制取无色AlCl3 | 加热蒸发AlCl3溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 |
| B、食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 |
| C、保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
| D、地沟油分子中碳原子数过多,相对分子质量过大是地沟油不宜直接用作燃料油的原因之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
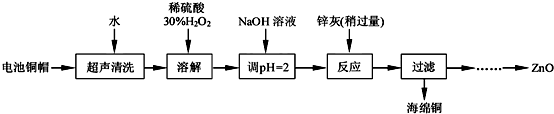
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.0 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将大小、形状相同的镁条和铝条与同浓度、同温度下的盐酸反应时,两者快慢相同 |
| B、盛有相同浓度的双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 |
| C、将浓硝酸分别放在的冷暗处和强光,发现强光下的浓硝酸分解得快 |
| D、将相同浓度Na2S2O2溶液与硫酸溶液混合,升高温度后溶液出现浑浊的时间变短,原因是反应物分子的能量增加,单位体积内活化分子百分数增大,有效碰撞次数增 |
查看答案和解析>>
科目:高中化学 来源: 题型:
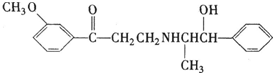
| A、可以在催化剂作用下和溴反应 |
| B、可以在碱性条件下发生水解反应 |
| C、能够使酸性高锰酸钾溶液褪色 |
| D、可以和浓硫酸与浓硝酸的混合液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com