

���� I����1��Ga��ԭ������Ϊ31��λ�ڵ������ڵڢ�A�壻
��2��Ga��NH3�ڸ��������·�Ӧ����GaN��������
��3����λ�ڵڢ�A�壬λ�ڽ�����ǽ������紦����Al�����������ʣ������Ա�Alǿ���Դ˷����䵥�ʺͻ���������ʣ�
II����4��ZnFe2O4����д��ZnO•Fe2O3�����ʱZnFe2O4�����������Σ���ZnFe2O4�����ᷴӦ��������п����������
��5��Fe��OH��3���壨���������е������ԣ�
��6��п��ɰ�к���CaO��FeO��CuO��NiO���������Ӧ����Һ�д���Cu2+��Ni2+��û�о���������������ȡ��п�Ậ��ͭ��Ni�����ʣ�
��7���ٷϾɸɵ��пƤ����������������пƬ��ȫ�����Թ�����3 mol•L-1ϡ���ᣬ������Һ�к�����������Fe2+�����뽫���ȥ�����ͼ��������ϢZn2+��Fe2+���Է��룬�����Ƚ�Fe2+����ΪFe3+�ٽ��з��룬Ϊ�������µ����ʣ�ѡ��30%H2O2����������
�ڷ���Zn2+��Fe3+�����ͼ���������ˮ��ԭ��ͨ������pH�ķ������г��ӣ�
��������ˮ��Ϊ���ȷ�Ӧ��H2O2�����ֽ⣮
��� �⣺��1��Ga��ԭ������Ϊ31��λ�ڵ������ڵڢ�A�壬�ʴ�Ϊ���������ڵڢ�A�壻
��2��Ga��NH3�ڸ��������·�Ӧ����GaN����������ӦΪ2Ga+2NH3$\frac{\underline{\;����\;}}{\;}$2GaN+3H2���ʴ�Ϊ��2Ga+2NH3$\frac{\underline{\;����\;}}{\;}$2GaN+3H2��
��3����λ�ڵڢ�A�壬λ�ڽ�����ǽ������紦����Al�����������ʣ���
A��Al�����ᡢNaOH����Ӧ����һ�������£�Ga������������������ƣ���A��ȷ��
B��Al��ˮ���²���Ӧ�������£�Ga������ˮ���ҷ�Ӧ�ų���������B����
C���������������������ֽ����ɣ���Ga2O3����Ga��OH��3���ȷֽ�õ�����C��ȷ��
D����������NaOH��Ӧ�����Σ���һ�������£�Ga2O3����NaOH��Ӧ�����Σ���D��ȷ��
�ʴ�Ϊ��ACD��
��4��������Ϣ�����ʱZnFe2O4�����������Σ��������ηֱ�Ϊ����п������������ZnFe2O4�����ᷴӦ��������п������������Ӧ�Ļ�ѧ����ʽΪZnFe2O4+4H2SO4�TZnSO4+Fe2��SO4��3+4H2O��
�ʴ�Ϊ��ZnFe2O4+4H2SO4�TZnSO4+Fe2��SO4��3+4H2O��
��5����ΪFe��OH��3�������������ԣ���I���ɵij����л�������Һ�е��������ʣ��ʴ�Ϊ��Fe��OH��3�������������ԣ�
��6��CaO��FeO��CuO��NiO��������������ת��Ϊ�������ӣ�����I���ȥFeԪ�أ�����II�м���Zn��Ŀ����ʹCu2+��Ni2+ת��ΪCu��Ni����ȥ��
�ʴ�Ϊ��ʹCu2+��Ni2+ת��ΪCu��Ni����ȥ��
��7���پ������÷Ͼɸɵ��пƤ��������������ȡ������ZnSO4��Һʵ������Ϊ���������ܡ����ӣ���ʵ�鲽��ٽ�пƬ��ȫ�����Թ�����3 mol•L-1ϡ���ᷢ���ķ�ӦΪZn+2H+=Zn2++H2����Fe+2H+=Fe2++H2����������Һ�к�����������Fe2+�����뽫���ȥ�����ͼ��������ϢZn2+��Fe2+���Է��룬�����Ƚ�Fe2+����ΪFe3+�ٽ��з��룬����Ҫ�ӹ������������������ӣ�
�ʴ�Ϊ��A��
�ڷ���Zn2+��Fe3+�����ͼ���������ˮ��ԭ��ͨ������pH�ķ������г��ӣ�Ϊ��ֹ�������ʿ��ô�ZnO��ĩ������pH��ʹFe3+ת��ΪFe��OH��3��������ȥ��
�ʴ�Ϊ��C��
��������ˮ�����ȣ������ܴٽ����������ӵ�ˮ�⣬H2O2�����ֽ⣬���Բ���ۼ��ȵ���ҪĿ���дٽ�Fe3+ˮ��ת��Ϊ������ͬʱʹ������H2O2�ֽ��ȥ��
�ʴ�Ϊ���ٽ�Fe3+ˮ��ת��Ϊ��������ʹ������H2O2�ֽ��ȥ��
���� ���⿼����ۺϣ��漰Ԫ�����ڱ���Ԫ�������ɡ���ѧ�������̡����ʵ��Ʊ����������������ᴿ�ۺ�Ӧ�á��������ʼ�����������ʣ�����ƴ������Ŀ�����ط�����Ǩ��Ӧ�������Ŀ��飬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ƿʵ��ǰ������ˮϴ�ɾ�����δ��� | |
| B�� | ���ݹ۲�Һ��ʱ���� | |
| C�� | ����Ͳ��ȡһ����Һ��ʱ������Һ����� | |
| D�� | ������ˮʱ���������˿̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ʴ���ǽ���ʧȥ���ӱ���ԭ�Ĺ��� | |
| B�� | �Ͻ���۵㶼�������ijɷֽ������Ͻ����ʴ��Ҳ������ɷֽ���ǿ | |
| C�� | ͭ���ϵ���í�����ڳ�ʪ�Ŀ�����ֱ�ӷ�����Ӧ��Fe-3e-=Fe3+���̶��γ����� | |
| D�� | ��ˮ���е�ˮբ���ְ壩�����ֱ����Դ�ĸ����������������ӵ�һ������Ͽɷ�ֹˮբ����ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢܢ� | B�� | �ڢۢ� | C�� | �ڢܢݢ� | D�� | �ڢۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 400 | 500 | 830 |
| ƽ�ⳣ��K | 10 | 9 | 1 |
| ʵ���� | ��Ӧ��Ͷ���� | ƽ��ʱH2Ũ�� | ���ջ�ų������� | ��Ӧ��ת���� |
| A | 1��1��0��0 | c1 | Q1 | ��1 |
| B | 0��0��2��2 | c2 | Q2 | ��2 |
| C | 2��2��0��0 | c3 | Q3 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

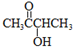 ��
�� CH3COO-+NH4++2Ag��+3NH3+H2O��
CH3COO-+NH4++2Ag��+3NH3+H2O�� ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ù��˵ķ�������FeCl3��Һ��Fe��OH��3���� | |
| B�� | Fe��OH��3���徲�û�ֲ� | |
| C�� | HCl��SO2��Fe2+���������������л�ԭ�� | |
| D�� | CH3COONH4�ĵ��뷽��ʽΪ��CH3COONH4 CH3COO-+NH4+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com